Перейти к:
Коронарная микроваскулярная дисфункция: значимость маркеров симпатической активности и вегетативного дисбаланса
https://doi.org/10.15829/1560-4071-2025-6335
EDN: BXXWUK
Аннотация
Цель. Изучить взаимосвязь адреномедуллина, катестатина, норадреналина и параметров вариабельности ритма сердца (ВРС) с коронарной микроваскулярной дисфункцией (КМД) у пациентов с необструктивным поражением коронарных артерий (КА).
Материал и методы. В исследование включено 29 пациентов (55 (51; 63) лет) с сохраненной фракцией выброса левого желудочка (63 (61; 66)%) и необструктивным поражением КА. Оценку сывороточных уровней биомаркеров выполняли исходно и через 12 мес. наблюдения с помощью иммуноферментного анализа. По данным динамической однофотонной эмиссионной компьютерной томографии оценивали стандартные полуколичественные индексы нарушения миокардиальной перфузии и параметры миокардиального кровотока. При отсутствии обструктивного поражения КА снижение уровня резерва миокардиального кровотока (CFR) ≤2 расценивалось как наличие КМД. По данным суточного мониторирования электрокардиограммы определяли показатели ВРС.
Результаты. В зависимости от наличия КМД пациенты были разделены на 2 группы: группа "КМД+" (n=14) и группа "КМД-" (n=15). По данным суточного мониторирования электрокардиограммы у пациентов с КМД выявлено снижение общей ВРС и показателей симпатической активности. Уровни катестатина значимо коррелировали с миокардиальным кровотоком в покое (r=0,329; p=0,019) и параметрами ВРС: средним значением продолжительности всех интервалов R-R (N-N) синусового ритма (среднее NN) (r=-0,410; p=0,001), SDANN (r=-0,276; p=0,036) и SDNNidx (r=0,287; p=0,029). Концентрации норадреналина были взаимосвязаны только с CFR (r=-0,295; p=0,037), а адреномедуллина — со средним NN (r=0,272; p=0,038). Уровни биомаркеров значимо не различались между группами исходно и через 12 мес. При этом уровни норадреналина практически не изменялись в течение проспективного наблюдения, тогда как уровни катестатина у пациентов с "КМД+" имели тенденцию к увеличению на 11,7% (р=0,632), а в группе "КМД-" — на 16,1% (р=0,632), а адреномедуллина — на 19,4% (p=0,325) и 23,7% (р=0,527), соответственно. Независимыми факторами, связанными с КМД, являлись подавление симпатической активности, выражающееся в снижении rMSSD (квадратного корня из средней суммы квадратов разностей между соседними NN-интервалами) ≤60 мс (отношение шансов 1,065; 95% доверительный интервал: 1,005-1,675; р=0,001) и индекс массы тела ≥27,8 кг/м2 (отношение шансов 1,061; 95% доверительный интервал: 0,998-1,668; р=0,001).
Заключение. Уровни норадреналина, адреномедуллина и катестатина значимо не различались у пациентов с наличием КМД и без нее, однако концентрации катестатина были взаимосвязаны с миокардиальным кровотоком в покое и параметрами ВРС, тогда как значения норадреналина были взаимосвязаны с CFR, а адреномедуллина — ассоциировались со средним NN.
Ключевые слова
Для цитирования:
Копьева К.В., Гракова Е.В., Мальцева А.Н., Мочула А.В., Гусакова А.М., Солдатенко М.В., Коваленко Г.В., Колмакова А.М., Аптекарь В.Д., Пушникова Е.Ю., Завадовский К.В. Коронарная микроваскулярная дисфункция: значимость маркеров симпатической активности и вегетативного дисбаланса. Российский кардиологический журнал. 2025;30(7):6335. https://doi.org/10.15829/1560-4071-2025-6335. EDN: BXXWUK
For citation:
Kopyeva K.V., Grakova E.V., Maltseva A.N., Mochula A.V., Gusakova A.M., Soldatenko M.V., Kovalenko G.V., Kolmakova A.M., Aptekar V.D., Pushnikova E.Yu., Zavadovsky K.V. Coronary microvascular dysfunction: the importance of markers of sympathetic activity and autonomic imbalance. Russian Journal of Cardiology. 2025;30(7):6335. (In Russ.) https://doi.org/10.15829/1560-4071-2025-6335. EDN: BXXWUK
В последние годы растет понимание важности оценки функции микроциркуляции коронарного русла, т.к. даже при отсутствии обструктивного коронарного атеросклероза более чем у половины пациентов с жалобами на ангинозные боли выявляются признаки коронарной микроваскулярной дисфункции (КМД), что ассоциируется с повышенным риском смертности и развития инфаркта миокарда [1-3]. КМД была обманчиво признана женским заболеванием: исследование WISE (Women’s Ischemia Syndrome Evaluation) показало, что 39% женщин, у которых наблюдались боли в груди и отсутствовало обструктивное поражение коронаных артерий (КА), имели признаки индуцированной ишемии миокарда и коронарной вазомоторной дисфункции [4]. Однако Murthy VL, et al., установили, что КМД (диагностированная с помощью позитронно-эмиссионной томографии) широко распространена среди обоих полов (51% у мужчин vs 54% у женщин), поэтому не только женщины, но и мужчины находятся в зоне риска развития данной патологии [2].
Патофизиология КМД многогранна и охватывает множество механизмов, включая эндотелиальную дисфункцию, микрососудистое ремоделирование и реперфузионное повреждение, которые приводят к изменениям в регуляции сосудистой функции, нарушениям в микрососудистой структурной целостности и системным метаболическим расстройствам [5]. В результате нарушенная регуляция микрососудистого кровотока может привести к симпатической дисфункции [6]. Однако данных о вовлеченности вегетативного дисбаланса в патогенез КМД недостаточно.
Поэтому целью исследования являлось изучение взаимосвязи гуморальных факторов нейрогуморальной регуляции и симпато-парасимпатического баланса вегетативной нервной системы (ВНС) (адреномедуллина, катестатина, норадреналина) и параметров вариабельности ритма сердца (ВРС) с КМД у пациентов с необструктивным поражением КА.
Материал и методы
Исследование являлось одноцентровым проспективным наблюдательным. Набор пациентов осуществлялся на базе Научно-исследовательского института кардиологии — филиала Федерального государственного бюджетного научного учреждения "Томский национальный исследовательский медицинский центр Российской академии наук". Исследование было проведено в соответствии с положениями Хельсинкской декларации и одобрено локальным этическим комитетом данного института (протокол № 204 от 18.11.2020). Информированное письменное согласие получено от всех пациентов до начала процедур исследования. В исследование включено 29 пациентов (55 (51; 63) лет) с сохраненной фракцией выброса (ФВ) левого желудочка (ЛЖ) (63 (61; 66)%) и необструктивным поражением КА (<50%), соответствующих критериям включения/исключения. Дизайн исследования представлен на рисунке 1.
Динамическая однофотонная эмиссионная компьютерная томография и перфузионная сцинтиграфия миокарда. За 48 ч до исследования все пациенты прекращали прием антиангинальных препаратов, а также кофеина и производных метилксантина. Исследования проводились в утренние часы по двухдневному протоколу "покой-нагрузка". В качестве радиофармпрепарата использовали 99mTc-метокси-изобутил-изотнитрил (болюсно 260-444 МБк), стресс-агента — аденозинтрифосфат (160 мкг/кг/мин в течение 4 мин). Исследования проводились на гибридном компьютерном томографе Discovery NM/CT 570с (GE Healthcare, США), оснащенном гамма-камерой с высокочувствительными полупроводниковыми теллурид кадмия-цинковыми-детекторами. Общая эффективная лучевая нагрузка ~6,25 мЗв.
Полученные сцинтиграфические изображения обрабатывали на специализированной рабочей станции Xeleris II (GE Healthcare, Израиль). Определяли стандартные полуколичественные индексы нарушения мио- кардиальной перфузии: Summed Stress Score — сумма баллов при нагрузке, Summed Rest Score — сумма баллов в покое, Summed Difference Score — разница между нагрузкой и покоем, а также количественные показатели: Stress Myocardial Blood Flow (stress-MBF, мл/мин/г) — миокардиальный кровоток при нагрузке, Rest Myocardial Blood Flow (rest-MBF, мл/мин/г) — миокардиальный кровоток в покое, coronary flow reserve (CFR) — резерв коронарного кровотока. При отсутствии обструктивного поражения КА снижение уровня CFR ≤2 расценивалось как наличие КМД [7, 8].
Эхокардиография. Двухмерную трансторакальную эхокардиографию выполняли в исследовании на ультразвуковом сканере с улучшенной визуализацией Philips Affiniti 70. Конечно-диастолический объём (КДО) измеряли в момент времени в диастолу, конечно-систолическое измерение выполняли непосредственно в момент времени, предшествующий открытию митрального клапана. ФВ ЛЖ определяли по методу Симпсон (Simpson) как отношение разности объемов ЛЖ к исходному объему:
ФВ=(КДО–КСО)/КДО,
где КДО — конечно-диастолический объем; КСО — конечно-систолический объем.
ВРС. Параметры ВРС анализировали по данным 24-ч мониторирования электрокардиограммы. Не менее чем за 48 ч до проведения исследования пациентам отменяли β-блокаторы. Оценивали параметры ВРС avNN; SDNN; SDANN; SDNNidx; rMSSD; NN50, 100, 200; pNN50, 100, 200. Подробная характеристика параметров ВРС и их интерпретация представлены в другой нашей работе [9].
Биохимический анализ. Забор крови осуществлялся утром натощак, а образцы сыворотки, полученные после центрифугирования, хранились при температуре -24 C. Лабораторные анализы включали определение уровней гемоглобина, креатинина с расчетом скорости клубочковой фильтрации по формуле Chronic Kidney Disease Epidemiology Collaboration (CK-EPI), общего холестерина, триглицеридов. Концентрации N-концевого промозгового натрийуретического пептида, адреномедуллина, норадреналина и катестатина в сыворотке крови определяли с помощью иммуноферментного анализа (N-концевой промозговой натрийуретический пептид, Biomedica, Австрия; адреномедуллин, норадреналин и катестатин, RayBiotech, Тайвань).
Статистический анализ. Статистическая обработка результатов исследования проводилась с помощью программ STATISTICA 10.0 и MedCalc 11.5.0.0. Для проверки статистических гипотез при сравнении 2 независимых групп использовали критерий Манна-Уитни. При анализе качественных признаков проводили анализ таблиц сопряженности с использованием критерия χ2 Пирсона. Данные представляли в виде медианы (Me) и межквартильного интервала (Q — 25-й и 75-й процентили). Для выявления ассоциации между количественными параметрами использовали критерий корреляции Спирмена. Расчет отношения шансов и 95% доверительного интервала для оценки унивариантной взаимосвязи факторов с наличием КМД проводили с помощью однофакторного регрессионного анализа. Независимые предикторы наличия КМД рассчитывали с помощью многофакторного регрессионного анализа. Критический уровень значимости p-value для всех используемых процедур анализа принимали равным 0,05.
Конечные точки. Первичными конечными точками являлись общая смертность, нефатальный инфаркт миокарда или инсульт, коронарная реваскуляризация и госпитализация по причине декомпенсации сердечной недостаточности.
Результаты
В зависимости от наличия КМД пациенты были разделены на 2 группы: группа "КМД+" (n=14) и группа "КМД-" (n=15). Пациенты с КМД имели более высокий индекс массы тела (ИМТ) (p=0,033), и у них чаще в анамнезе диагностировали сахарный диабет (р=0,001) и хроническую сердечную недостаточность (р=0,002). По остальным клинико-демографическим характеристикам группы были сопоставимы (табл. 1).
По данным суточного мониторирования электрокардиограммы у пациентов с КМД выявлено снижение общей ВРС за счет выраженного подавления парасимпатического звена регуляции ВНС: значения SDNNidx были ниже на 16,9% (р=0,021), rMSSD — в 2,5 раза (р=0,008), ppNN50 — в 3,98 раз (р=0,025), NN 100 — в 1,8 раз (р=0,037), pNN 100 — в 9,8 раз (р=0,016), а pNN 200 — в 7,3 раза (р=0,032) (табл. 2).
Группы пациентов различались по стандартным полуколичественным индексам нарушения миокардиальной перфузии, таким как SSS (сумма баллов при нагрузке) и SDS (разница между нагрузкой и покоем): SSS и SDS были значимо выше у пациентов с КМД (p=0,048 и p=0,036, соответственно), тогда как сумма баллов в покое значимо не различалась. Параметры миокардиального кровотока значимо различались между группами и представлены на рисунке 2.
Уровни катестатина значимо коррелировали с rest-MBF (r=0,329; p=0,019), средним NN-интервалов (r=-0,410; p=0,001), SDANN (r=-0,276; p=0,036) и SDNNidx (r=0,287; p=0,029). Концентрации норадреналина были взаимосвязаны только с CFR (r=-0,295; p=0,037), а адреномедуллина — со средним NN (r=0,272; p=0,038) (рис. 3).
У пациентов с КМД уровни адреномедуллина значимо не различались как исходно на момент включения в исследование (р=0,156), так и через 12 мес. наболюдения (р=0,325). Однако как в группе "КМД+", так и в группе "КМД-" имелась тенденция к возрастанию уровней данного биомаркера на 19,4% (p=0,325) и 23,7% (р=0,527), соответственно (рис. 3).
Уровни норадреналина и катестатина также значимо не различались между группами исходно и через 12 мес. При этом уровни норадреналина практически не изменялись в течение проспективного наблюдения, а уровни катестатина у пациентов с "КМД+" имели тенденцию к увеличению на 11,7% (р=0,632), а в группе без "КМД-" на 16,1% (р=0,632) (рис. 4, 5).
По данным однофакторного регрессионного анализа (табл. 3) гиперэкспрессия адреномедуллина ≥24,773 нг/мл, катестатина ≥202,64 нг/мл, снижение pNN50 ≤12,4% и rMSSD ≤60 мс, наличие сахарного диабета 2 типа, а также ИМТ ≥27,8 кг/м2 и снижение скорости клубочковой фильтрации ≤70,04 мл/мин/м2 были ассоциированы с КМД. Независимыми факторами, связанными с КМД, являлись только rMSSD и ИМТ.
В течение 12 мес. наблюдение только у двух пациентов были зарегистрированы первичные конечные точки: в одном случае зарегистрирован смертельный исход из-за острого инфаркта миокарда и еще в одном случае развился нефатальный ишемический инсульт. В связи с небольшим количеством неблагоприятных сердечно-сосудистых событий (n=2; 6,8%), зарегистрированных в течение 12 мес., невозможно было оценить связь изучаемых биомаркеров с неблагоприятными исходами.
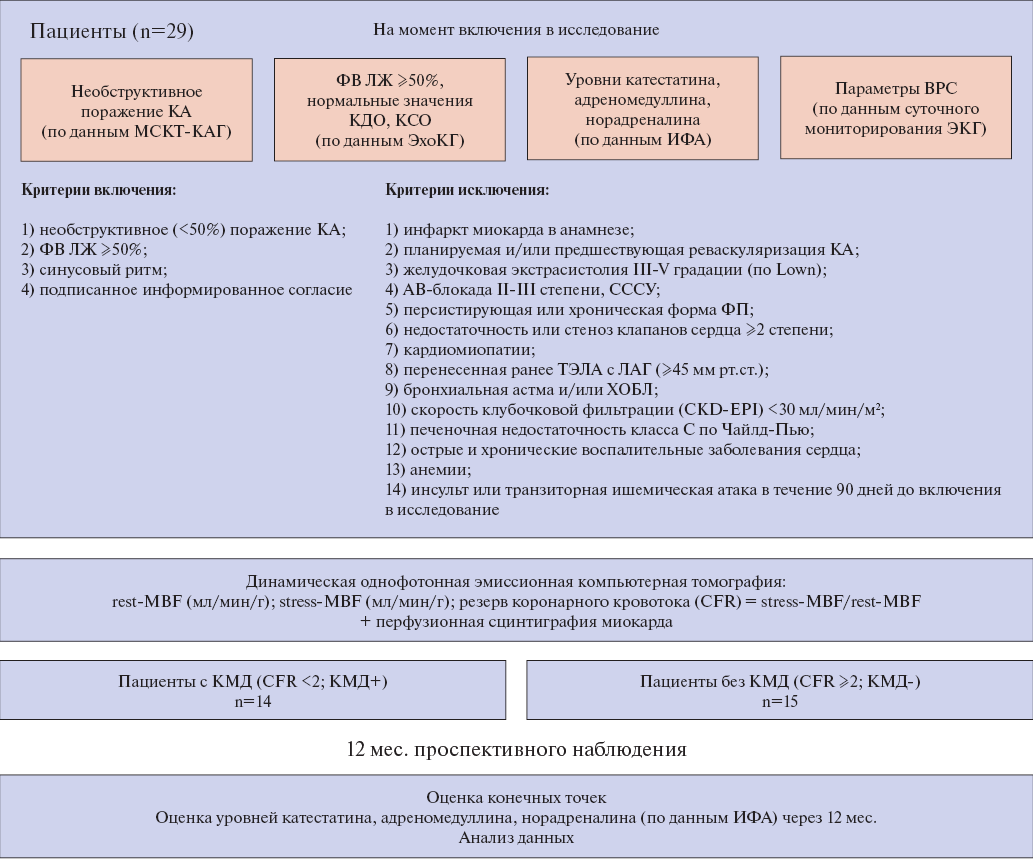
Рис. 1. Дизайн исследования.
Сокращения: АВ-блокада — атриовентрикулярная блокада, ВРС — вариабельность ритма сердца, ИФА — иммуноферментный анализ, КА — коронарные артерии, КДО — конечно-диастолический объем, КМД — коронарная микроваскулярная дисфункция, КСО — конечно-систолический объем, ЛАГ — легочно-артериальная гипертензия, МСКТ-КАГ — мультиспиральная компьютерная томография коронарных артерий, СССУ — синдром слабости синусового узла, ТЭЛА — тромбоэмболия легочной артерии, ФВ ЛЖ — фракция выброса левого желудочка, ФП — фибрилляция предсердий, ХОБЛ — хроническая обструктивная болезнь легких, ЭКГ — электрокардиограмма, ЭхоКГ — эхокардиография, CFR — резерв коронарного кровотока, rest-MBF — миокардиальный кровоток в покое, stress-MBF — миокардиальный кровоток в условиях стресс-теста с аденозином.
Таблица 1
Исходная клинико-демографическая характеристика пациентов в зависимости от наличия КМД на момент включения в исследование
|
Параметр |
КМД+; n=14 |
КМД-; n=15 |
p-value |
|
Возраст, годы |
54,5 (50; 58) |
57 (50; 64) |
0,651 |
|
Мужчины, n (%) |
6 (0,4) |
10 (66,7) |
1,198 |
|
Индекс массы тела, кг/м2 |
31,4 (28,72; 35,62) |
27,4 (24,5; 31,21) |
0,033 |
|
Гипертоническая болезнь, n (%) |
13 (92,9) |
14 (93,3) |
0,157 |
|
Ишемическая болезнь сердца, n (%) |
3 (21,4) |
7 (46,7) |
0,153 |
|
Сахарный диабет 2 типа, n (%) |
2 (14,3) |
0 (0,0) |
0,001 |
|
ХСНсФВ, n (%) |
6 (42,9) |
3 (0,2) |
0,002 |
|
Курение, n (%) |
4 (28,6) |
6 (0,4) |
0,517 |
|
Гемоглобин, г/л |
133 (129; 144) |
137 (123; 146) |
0,614 |
|
СКФ (мл/мин/1,73 м2) |
78,7 (56,8; 96,3) |
68,2 (64,94; 75) |
0,310 |
|
Общий холестерин, ммоль/л |
5,46 (4,3; 5,99) |
49 (47,5; 50,5) |
0,747 |
|
Триглицериды, ммоль/л |
1,8 (1,08; 2,55) |
1,55 (0,78; 2,62) |
0,914 |
|
NT-proBNP, пг/мл |
109,65 (87,65; 981,5) |
67,8 (45,9; 165,8) |
0,001 |
|
Фракция выброса левого желудочка, % |
65 (64; 68) |
65 (63; 66) |
0,919 |
|
Конечный диастолический размер, мм |
50 (49; 52) |
49 (47,5; 50,5) |
0,168 |
|
Конечный систолический размер, мм |
32 (30; 34) |
30,5 (29; 32,5) |
0,376 |
Сокращения: СКФ — скорость клумбочкой фильтрации (по формуле CKD-EPI), ХСНсФВ — хроническая сердечная недостаточность с сохраненной фракцией выброса, NT-proBNP — N-концевой промозговой натрийуретический пептид.
Таблица 2
Параметры ВРС в зависимости от наличия КМД
|
Параметр |
КМД+; n=14 |
КМД-; n=15 |
p-value |
|
avNN, мс |
927,5 (850; 965) |
935 (769; 1005) |
0,835 |
|
SDNN, мс |
117 (90; 128) |
136 (92; 189) |
0,077 |
|
SDANN, мс |
91 (70; 104) |
102 (72; 112) |
0,229 |
|
SDNNidx, мс |
59 (52; 72) |
71 (53; 165) |
0,021 |
|
rMSSD, мс |
31,5 (30; 60) |
80 (33; 221) |
0,008 |
|
NN50 |
4132,5 (3345; 8670) |
9901 (3578; 28253) |
0,118 |
|
pNN50, % |
5,7 (4,5; 12,4) |
22,7 (5; 39,5) |
0,025 |
|
NN 100 |
868 (269; 1490) |
1584 (672; 15140) |
0,037 |
|
pNN 100, % |
0,95 (0,4; 2,8) |
8,8 (1,0; 23,2) |
0,016 |
|
NN 200 |
260,5 (90; 489) |
1291 (160; 3529) |
0,146 |
|
pNN 200, % |
0,3 (0,1; 1,0) |
2,2 (0,3; 16,2) |
0,032 |
Сокращения: avNN — среднее значение продолжительности всех интервалов R-R синусового ритма (NN-интервалов), SDNN — стандартное отклонение R-R-интервалов, SDANN — стандартное отклонение средних NN-интервалов на всех 5-мин сегментах, SDNNidx — среднее значение стандартных отклонений NN-интервалов, вычисленных по 5-мин промежуткам в указанный период записи, rMSSD — квадратный корень из средней суммы квадратов разностей между соседними NN-интервалами, NN50 (100, 200) — количество пар соседних NN-интервалов, различающихся более чем на 50 (100, 200) мс, pNN50 (100, 200) — значение NN50 (100, 200), деленное на общее число NN интервалов анализируемого периода мониторирования.
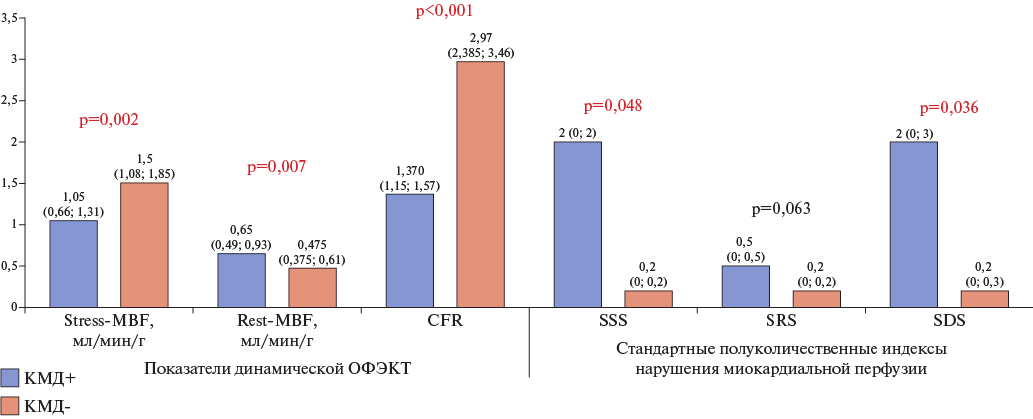
Рис. 2. Показатели динамической однофотонной эмиссионной компьютерной томографии и индексы нарушения перфузии в зависимости от наличия КМД на момент включения в исследование.
Сокращения: КМД — коронарная микроваскулярная дисфункция, ОФЭКТ — однофотонная эмиссионная компьютерная томография, CFR — резерв коронарного кровотока, Р-value — уровень значимости для процедур статистического анализа, stress-MBF — миокардиальный кровоток в условиях стресс-теста с аденозинтрифосфатом, rest-MBF — миокардиальный кровоток в покое, SDS — разница между нагрузкой и покоем, SSS — сумма баллов при нагрузке, SRS — сумма баллов в покое.
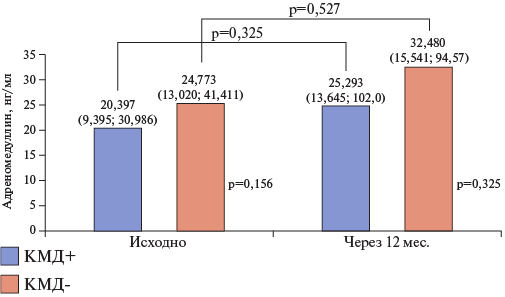
Рис. 3. Уровни адреномедуллина исходно и в динамике через 12 мес. в зависимости от наличия КМД.
Сокращения: КМД — коронарная микроваскулярная дисфункция, p-value — уровень значимости для процедур статистического анализа.
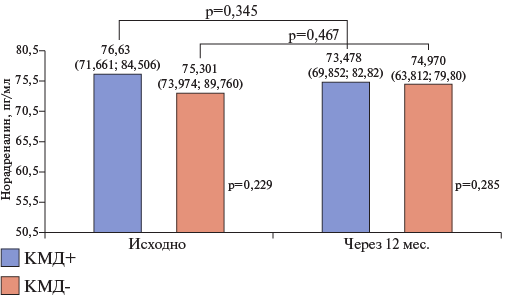
Рис. 4. Уровни норадреналина исходно и в динамике через 12 мес. в зависимости от наличия КМД.
Сокращения: КМД — коронарная микроваскулярная дисфункция, p-value — уровень значимости для процедур статистического анализа.
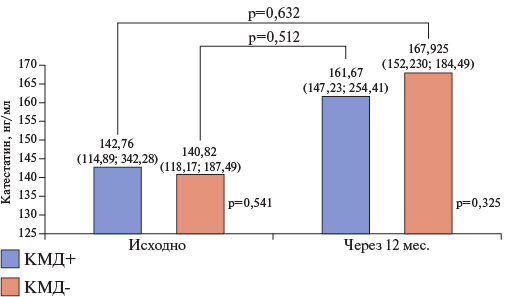
Рис. 5. Уровни катестатина исходно и в динамике через 12 мес. в зависимости от наличия КМД.
Сокращения: КМД — коронарная микроваскулярная дисфункция, p-value — уровень значимости для процедур статистического анализа.
Таблица 3
Результаты однофакторного и многофакторного регрессионного анализа
|
Параметр |
Однофакторный анализ, ОШ (95% ДИ) |
p-value |
Многофакторный анализ, ОШ (95% ДИ) |
p-value |
|
Адреномедуллин (≥24,773 нг/мл) |
1,991 (0,992-3,122) |
0,049 |
– |
– |
|
pNN50 (≤12,4%) |
1,273 (0,951-1,996) |
0,024 |
– |
– |
|
rMSSD (≤60 мс) |
1,211 (0,991-1,512) |
0,047 |
1,065 (1,005-1,675) |
0,001 |
|
Индекс массы тела (≥27,8 кг/м2) |
1,197 (1,074-1,332) |
0,001 |
1,061 (0,998-1,668) |
0,001 |
|
Женский пол |
1,375 (1,157-1,896) |
0,027 |
– |
– |
|
СКФ (≤70,04 мл/мин/м2) |
1,038 (1,009-1,067) |
0,009 |
– |
– |
|
Сахарный диабет 2 типа |
1,679 (1,009-2,067) |
0,004 |
– |
– |
Сокращения: ДИ — доверительный интервал, ОШ — отношение шансов, СКФ — скорость клумбочкой фильтрации (по формуле CKD-EPI), pNN50 (100, 200) — значение NN50 (100, 200), деленное на общее число NN интервалов анализируемого периода мониторирования, rMSSD — квадратный корень из средней суммы квадратов разностей между соседними NN-интервалами.
Обсуждение
Коронарная микроциркуляция играет фундаментальную роль в регуляции коронарного кровотока в ответ на потребность сердца в кислороде. Нарушение этого механизма, возникающее на фоне такой сопутствующей патологии, как сахарный диабет, гипертония, ожирение и др., и определяемое как КМД, повышает риск развития неблагоприятных сердечно-сосудистых клинических исходов [10]. Основной механизм коронарной вазомоторной дисфункции может быть эндотелий-зависимым и эндотелий-независимым, связанный с тонусом кардиомиоцитов [11]. При этом симпатические и парасимпатические влияния могут модулировать как артериальный тонус, так напрямую воздействовать на сосудистые гладкомышечные клетки или стимулировать высвобождение NO из эндотелия [11].
В норме в состоянии покоя симпатический контроль коронарного вазомоторного тонуса незначителен и зависит от баланса между преобладающей β-адренергической вазодилатацией и α-адренергической вазоконстрикцией, которая имеет лишь ограниченный эффект [12]. Во время повышенной физической нагрузки β-адренергическая активация, включающая в основном β2-адренорецепторы, способствует коронарной вазодилатации для компенсации повышенного потребления кислорода миокардом, составляя примерно 25% гиперемии при нагрузке [13]. Однако при КМД вазоконстрикция, опосредованная α1-адренергическими рецепторами, становится более интенсивной, снижает приток крови и может привести к ишемии миокарда, тем самым запуская "порочный круг", приводящий в последующем к вегетативному дисбалансу ВНС [10-13], который может найти свое отражение в параметрах ВРС и изменении концентраций циркулирующих биомаркеров [9]. В данном исследовании мы подтвердили тот факт, что у пациентов с КМД имеет место вегетативная дисфункция, проявляющаяся снижением общей ВРС за счет выраженного подавления парасимпатического звена регуляции ВНС: снижение значений SDNNidx отражает нарастание симпатической эфферентации, а снижение показателей, вычисленных на основе разницы между R-R интервалами, — напряжение парасимпатической нервной системы [9]. И несмотря на то, что концентрации норадреналина значимо не различались у пациентов с КМД и без нее, они были взаимосвязаны с резервом миокардиального кровотока (r=-0,295; p=0,037).
Одним из новых перспективных биомаркеров, который может быть вовлечен в регуляцию сосудистого тонуса, является адреномедуллин. Этот гормон, синтезируемый и секретируемый в основном эндотелиальными и гладкомышечными клетками сосудистой стенки, отвечает за вазодилатацию и, по результатам последних исследований, может являться предиктором смертности и неблагоприятных сердечно-сосудистых событий [14]. В нашем исследовании данный биомаркер не различался по уровням между группами, но имел слабой силы положительную взаимосвязь со средним значением продолжительности всех интервалов R-R синусового ритма, что косвенно отражает преобладающую вазоконстрикцию на фоне снижения парасимпатических влияний. Другой биомаркер катестатин — пептид, супрессор и ингибитор высвобождения катехоламинов [15] — также имел положительную корреляцию с миокардиальным кровотоком в покое и SDNNidx, отрицательную — со средним NN и SDANN, что также может свидетельствовать о наличии вегетативного дисбаланса у пациентов с КМД. Кроме того, независимыми факторами, связанными с КМД кроме ИМТ ≥27,8 кг/м2, являлось и подавление симпатической активности, выражающееся в снижении rMSSD ≤60 мс, что может также свидетельствовать о вовлечении данного механизма в патогенез.
Отсутствие значимых различий концентраций биомаркеров между группами, вероятнее всего, свидетельствует о том, что симпатическая активность и вегетативный дисбаланс вряд ли являются лидирующими механизмами инициации и развития КМД и активируются вместе с эндотелиальной дисфункцией на фоне атеросклеротического поражения коронарного русла. Кроме того, это может быть связано и с небольшим количеством наблюдений, поэтому необходимы дальнейшие исследования по изучению данного механизма в этой когорте пациентов на бóльшей выборке.
Несмотря на то, что патогенез КМД детально изучается в последние годы, остается много нерешенных вопросов, в т.ч. касающихся эффективных методов ее лечения, а выявление дополнительных путей прогрессирования КМД является клинически важной проблемой. Прорыв в данной области потенциально будет способствовать широкому внедрению терапевтических методик в реальную клиническую практику.
Ограничения исследования. Основными ограничениями исследования являлись: 1) одноцентровое исследование с относительно небольшой выборкой больных; 2) недостаточное количество конечных точек для оценки прогностической роли маркеров симпатической активности; 3) непродолжительный период проспективного наблюдения — 12 мес.
Заключение
Таким образом, установлено, что при необструктивном поражении КА уровни норадреналина, адреномедуллина и катестатина значимо не различались у пациентов с наличием КМД и без нее, однако концентрации катестатина были взаимосвязаны с миокардиальным кровотоком в покое и параметрами ВРС, тогда как значения норадреналина были взаимосвязаны с CFR, а адреномедуллина ассоциировались со средним NN. Вероятнее всего это свидетельствует о том, что симпатическая активность и вегетативный дисбаланс не являются лидирующими механизмами инициации и развития КМД, и активируется вместе с эндотелиальной дисфункцией, способствуя ее дальнейшему прогрессированию.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Список литературы
1. Gdowski MA, Murthy VL, Doering M, et al. Association of isolated coronary microvascular dysfunction with mortality and major adverse cardiac events: a systematic review and meta-analysis of aggregate data. J Am Heart Assoc. 2020;9:e014954. doi:10.1161/JAHA.119.014954.
2. Murthy VL, Naya M, Taqueti VR, et al. Effects of sex on coronary microvascular dysfunction and cardiac outcomes. Circulation. 2014;129:2518-27. doi:10.1161/CIRCULATIONAHA.113.008507.
3. Mileva N, Nagumo S, Mizukami T, et al. Prevalence of Coronary Microvascular Disease and Coronary Vasospasm in Patients With Nonobstructive Coronary Artery Disease: Systematic Review and Meta-Analysis. J Am Heart Assoc. 2022;11(7): e023207. doi:10.1161/JAHA.121.023207.
4. Pepine CJ, Anderson RD, Sharaf BL, et al. Coronary microvascular reactivity to adenosine predicts adverse outcome in women evaluated for suspected ischemia. Results from the National Heart, Lung and Blood Institute WISE (Women’s Ischemia Syndrome Evaluation) study. J Am Coll Cardiol. 2010;55:2825-32. doi:10.1016/j.jacc.2010.01.054.
5. Tang N, Li KM, Li HR, et al. Advances in the diagnosis and management of post-percutaneous coronary intervention coronary microvascular dysfunction: Insights into pathophysiology and metabolic risk interactions. World J Cardiol. 2025;17(2):103950. doi:10.4330/wjc.v17.i2.103950.
6. Mehta PK, Thomson LEJ, Slomka PJ, et al. Cardiac Sympathetic Activity by 123I-MetaIodobenzylguanidine Imaging in Women With Coronary Microvascular Dysfunction: A Pilot Study. JACC Cardiovasc Imaging. 2021;14(9):1873-5. doi:10.1016/j.jcmg.2021.03.031.
7. Копьева К.В., Мальцева А.Н., Мочула А.В. и др. Неблагоприятные сердечно-сосудистые события у пациентов с коронарной микроваскулярной дисфункцией: результаты 12-месячного наблюдения с группой контроля. Российский кардиологический журнал. 2023;28(3):5269.doi:10.15829/1560-4071-2023-5269.
8. Мочула А.В., Мочула О.В., Мальцева А.Н. и др. Количественная оценка миокардиального кровотока методом динамической однофотонной эмиссионной компьютерной томографии миокарда: взаимосвязь с электрокардиографическими изменениями и биохимическими маркерами повреждения у пациентов с острым инфарктом миокарда. Сибирский журнал клинической и экспериментальной медицины.2023;39(3):66-74. doi:10.29001/2073-8552-2023-39-3-66-74.
9. Гракова Е.В., Копьева К.В., Гусакова А.М. и др. Сердечная недостаточность с сохраненной фракцией выброса левого желудочка при неокклюзирующем коронарном атеросклерозе: клиническая полезность оценки вариабельности сердечного ритма. Бюллетень сибирской медицины.2023;22(2):28-38. doi:10.20538/1682-0363-2023-2-28-38.
10. Vancheri F, Longo G, Vancheri S, et al. Coronary Microvascular Dysfunction. J. Clin. Med. 2020;9:2880. doi:10.3390/jcm9092880.
11. Duncker DJ, Koller A, Merkus D, et al. Regulation of coronary blood flow in health and ischemic heart disease. Prog Cardiovasc Dis. 2015;57(5):409-22. doi:10.1016/j.pcad.2014.12.002.
12. Ong P, Athanasiadis A, Borgulya G, et al. High Prevalence of a Pathological Response to Acetylcholine Testing in Patients With Stable Angina Pectoris and Unobstructed Coronary Arteries: The ACOVA Study (Abnormal Coronary Vasomotion in patients with stable angina and unobstructed coronary arteries). Am Coll Cardiol. 2012;59(7):655-62. doi:10.1016/j.jacc.2011.11.015.
13. Van de Hoef TP, Siebes M, Spaan JA, et al. Fundamentals in clinical coronary physiology: why coronary flow is more important than coronary pressure. Eur Heart J. 2015;36(47):3312-9a. doi:10.1093/eurheartj/ehv235.
14. Sacco MA, Gualtieri S, Cordasco F, et al. The Role of Adrenomedullin as a Predictive Marker of the Risk of Death and Adverse Clinical Events: A Review of the Literature. J. Clin. Med. 2024;13:4847. doi:10.3390/jcm13164847.
15. Гракова Е.В., Копьева К.В., Гусакова А.М. и др. Значимость катестатина в патогенезе сердечной недостаточности с сохраненной фракцией выброса левого желудочка у больных с неокклюзирующим коронарным атеросклерозом. Российский кардиологический журнал.2023;28(11):5568. doi:10.15829/1560-4071-2023-5568.
Об авторах
К. В. КопьеваРоссия
Копьева Кристина Васильевна — к.м.н., с.н.с. отделения патологии миокарда.
Томск
Конфликт интересов:
Нет
Е. В. Гракова
Россия
Гракова Елена Викторовна — д.м.н., в.н.с. отделения патологии миокарда.
Томск
Конфликт интересов:
Нет
А. Н. Мальцева
Россия
Мальцева Алина Николаевна — к.м.н., н.с. отделения рентгеновских и томографических методов диагностики.
Томск
Конфликт интересов:
Нет
А. В. Мочула
Россия
Мочула Андрей Викторович — к.м.н., с.н.с. лаборатории радионуклидных методов исследования.
Томск
Конфликт интересов:
Нет
А. М. Гусакова
Россия
Гусакова Анна Михайловна — к.фарм.н., н.с. отделения клинической лабораторной диагностики.
Томск
Конфликт интересов:
Нет
М. В. Солдатенко
Россия
Солдатенко Михаил Владимирович — к.м.н., н.с. отделения ультразвуковой диагностики.
Томск
Конфликт интересов:
Нет
Г. В. Коваленко
Россия
Коваленко Георгий Владимирович — студент 5 курса лечебного факультета.
Томск
Конфликт интересов:
Нет
А. М. Колмакова
Россия
Колмакова Арина Михайловна — студент 5 курса лечебного факультета.
Томск
Конфликт интересов:
Нет
В. Д. Аптекарь
Россия
Аптекарь Владимир Дмитриевич — д.м.н., зав. кардиологическим отделением № 4.
Томск
Конфликт интересов:
Нет
Е. Ю. Пушникова
Россия
Пушникова Елена Юрьевна — к.м.н., врач-кардиолог кардиологического отделения № 4.
Томск
Конфликт интересов:
Нет
К. В. Завадовский
Россия
Завадовский Константин Валерьевич — д.м.н., зав. отделом лучевой диагностики.
Томск
Конфликт интересов:
Нет
Дополнительные файлы
- Уровни норадреналина, адреномедуллина и катестатина значимо не различались у пациентов в зависимости от наличия или отсутствия коронарной микроваскулярной дисфункции (КМД).
- Концентрации катестатина значимо коррелировали с миокардиальным кровотоком в покое и параметрами вариабельности ритма сердца. Сывороточные уровни норадреналина были взаимосвязаны с резервом миокардиального кровотока, а адреномедуллина — со средним синусового ритма (NN).
- Независимыми факторами, связанными с КМД, являлись только rMSSD (квадратный корень из средней суммы квадратов разностей между соседними NN-интервалами) ≤60 мс и индекс массы тела ≥27,8 кг/м2.
Рецензия
Для цитирования:
Копьева К.В., Гракова Е.В., Мальцева А.Н., Мочула А.В., Гусакова А.М., Солдатенко М.В., Коваленко Г.В., Колмакова А.М., Аптекарь В.Д., Пушникова Е.Ю., Завадовский К.В. Коронарная микроваскулярная дисфункция: значимость маркеров симпатической активности и вегетативного дисбаланса. Российский кардиологический журнал. 2025;30(7):6335. https://doi.org/10.15829/1560-4071-2025-6335. EDN: BXXWUK
For citation:
Kopyeva K.V., Grakova E.V., Maltseva A.N., Mochula A.V., Gusakova A.M., Soldatenko M.V., Kovalenko G.V., Kolmakova A.M., Aptekar V.D., Pushnikova E.Yu., Zavadovsky K.V. Coronary microvascular dysfunction: the importance of markers of sympathetic activity and autonomic imbalance. Russian Journal of Cardiology. 2025;30(7):6335. (In Russ.) https://doi.org/10.15829/1560-4071-2025-6335. EDN: BXXWUK
JATS XML

















































