Перейти к:
Белки теплового шока в оценке течения и прогноза исходов хронической сердечной недостаточности с сохраненной фракцией выброса
https://doi.org/10.15829/1560-4071-2025-6317
EDN: YHFXWZ
Аннотация
Цель. Провести анализ взаимосвязи концентраций циркулирующих белков теплового шока (БТШ): БТШ27, БТШ70 и кардиоваскулярного БТШ (квБТШ) с течением хронической сердечной недостаточности с сохраненной фракцией выброса (ХСНсФВ) и исходами острой декомпенсации заболевания (ОДСНсФВ).
Материал и методы. Обследовано 120 больных с подтвержденным диагнозом ХСНсФВ в возрасте от 50 до 90 лет и острой декомпенсацией заболевания на момент взятия крови, а также 20 больных ХСНсФВ без клиники ОДСНсФВ. До начала лечения у пациентов проводилось взятие крови и получение сыворотки с ее последующим хранением при -80 0C для исследования биомаркеров иммуноферментным методом (реактивы компании AssayPro, США, и Cloud-Clone, Китай) на микропланшетном фотометре Thermo Multiscan FC (США). В интервале от 6 мес. до 1,5 лет у пациентов прослеживались летальные исходы.
Результаты. Медиана сывороточных уровней БТШ27, БТШ70 и квБТШ статистически значимо выше у пациентов с декомпенсированной, чем с компенсированной ХСНсФВ. Повышенные исходные уровни БТШ70 (>3,5 нг/мл) и квБТШ (>1321 пг/мл) у пациентов с ОДСНсФВ связаны с неблагоприятным прогнозом общей выживаемости. Для БТШ27 статистически значимых различий при анализе выживаемости не обнаружено.
Заключение. Выявлена связь сывороточных концентраций БТШ70 и квБТШ с неблагоприятным прогнозом общей выживаемости у пациентов с ОДСНсФВ, что позволяет рассматривать их в качестве потенциальных прогностических маркеров этого заболевания.
Ключевые слова
Для цитирования:
Тимофеев Ю.С., Веденикин Т.Ю., Афаунова А.Р., Замятин Р.А., Метельская В.Н., Джиоева О.Н., Иванова А.А., Нешкова Е.А., Покровская М.С., Драпкина О.М. Белки теплового шока в оценке течения и прогноза исходов хронической сердечной недостаточности с сохраненной фракцией выброса. Российский кардиологический журнал. 2025;30(4):6317. https://doi.org/10.15829/1560-4071-2025-6317. EDN: YHFXWZ
For citation:
Timofeev Yu.S., Vedenikin T.Yu., Afaunova A.R., Zamyatin R.A., Metelskaya V.A., Dzhioeva O.N., Ivanova A.A., Neshkova E.A., Pokrovskaya M.S., Drapkina O.M. Heat shock proteins in the assessment of the course and prognosis of heart failure with preserved ejection fraction. Russian Journal of Cardiology. 2025;30(4):6317. (In Russ.) https://doi.org/10.15829/1560-4071-2025-6317. EDN: YHFXWZ
Сложная патофизиология и высокая частота хронической сердечной недостаточности с сохраненной фракцией выброса (ХСНсФВ) остаются одной из главных проблем кардиологии. Распространенность этого заболевания, а также ассоциированные с ним уровни смертности и инвалидизации продолжают расти как в России, так и в мире [1-3]. Так, в Российской Федерации более половины госпитализаций, вызванных декомпенсацией сердечной недостаточности (СН), приходится на пациентов с ХСНсФВ. Декомпенсация ХСНсФВ значительно ухудшает прогноз для пациента и приводит к повышению вероятности повторных декомпенсаций и летального исхода [3]. Это подчеркивает важность разработки новых подходов к диагностике и тактике ведения пациентов с ХСНсФВ с оценкой прогноза. Согласно исследованиям, проведенным в российской популяции [4], более интенсивное наблюдение за пациентами с ХСНсФВ помогает снижать смертность от острой декомпенсации СН (ОДСН) в 3,5 раз.
Значительная гетерогенность фенотипов ХСНсФВ, а также многофакторная природа и сложность патофизиологии этого заболевания обосновывают необходимость при создании моделей прогнозирования исходов у пациентов с декомпенсацией ХСНсФВ учитывать широкий спектр маркеров риска, который включает клинико-анамнестические, инструментальные и лабораторные показатели [5-7]. В связи с этим проблема поиска, апробации и внедрения в клиническую практику надежных, малоинвазивных и доступных к использованию маркеров, позволяющих оценивать риск неблагоприятных исходов при декомпенсации ХСНсФВ, сохраняет свою актуальность.
Важную роль в патогенезе СН играет клеточный стресс, который отражает реакцию клеток на воздействие различных метаболических, воспалительных, окислительных факторов и приводит к активации белков теплового шока (БТШ) [8][9]. БТШ представляют собой семейство белков, выполняющих функцию молекулярных шаперонов для других белков клетки, участвующих в стабилизации клеточных структур, восстановлении конформации белковых молекул, предотвращении агрегации белков, восстановлении активности ферментов [8][10]. Отличительной особенностью БТШ является их гиперэкспрессия под влиянием таких стрессовых факторов, как тепловое воздействие, интоксикация, воспалительная реакция и тканевая гипоксия [11].
Клеточный стресс в миокарде, возникающий в ответ на многочисленные физиологические или патологические воздействия, нарушает белковый гомеостаз и вызывает аномальное сворачивание клеточных белков. Патологически измененные белки подвергаются воздействию БТШ; если шаперонной системе не удаётся вернуть денатурированные белки в нормальное состояние, происходит декомпенсация, в ходе которой развиваются порочные круги, в частности, из-за гиперсекреции БТШ, усиливающей хроническое воспаление [12-17].
Наиболее изученными биомаркерами клеточного стресса являются БТШ27, относящийся к низкомолекулярным "малым" БТШ и участвующий в АТФ-независимом звене и БТШ70 — высокомолекулярный БТШ, участвующий в АТФ-зависимом ответе на клеточный стресс [18-20]. Интересным в контексте кардиоваскулярных заболеваний является кардиоваскулярный БТШ (квБТШ, или БТШb7), который обладает кардиоспецифичностью и является шапероном актиновых микрофиламентов; до недавних пор данный белок исследовался, главным образом, на экспериментальных моделях [21].
Учитывая значение клеточного стресса в патогенезе СН, можно полагать, что перспективным направлением является изучение способности БТШ прогнозировать персонализированный риск неблагоприятных исходов декомпенсированной ХСНсФВ.
Цель работы: провести анализ взаимосвязи концентраций циркулирующих БТШ: БТШ27, БТШ70 и квБТШ с течением ХСНсФВ и исходами острой декомпенсации заболевания.
Материал и методы
В исследование включено 120 пациентов с острой декомпенсацией ХСНсФВ (ОДСНсФВ), проходивших лечение в ГБУЗ "Городская клиническая больница им. В. В. Вересаева Департамента здравоохранения города Москвы" в период с 02.10.2023 по 24.07.2024, составивших основную группу. В контрольную группу вошло 20 больных ХСНсФВ без ОДСНсФВ, сопоставимых по полу и возрасту с пациентами основной группы (табл. 1).
Критерии включения в основную группу: пациенты в возрасте от 50 до 90 лет, подписавшие информированное согласие, с диагнозом ОДСНсФВ. Диагноз ОДСНсФВ устанавливался по критериям, описанным в клинических рекомендациях [22], а именно: свойственные для диастолической дисфункции симптомы и признаки СН, структурные и/или функциональные изменения сердца; признаки ОДСНсФВ, при которой усугубляются симптомы и признаки СН с нарастанием одышки, застойных явлений, ортопноэ, появлением клиники "сердечной астмы" и/или отека легких на фоне какого-либо триггера, например, колебаний артериального давления или нарушений сердечного ритма и проводимости, таких как пароксизм фибрилляции предсердий (ФП) или брадикардия; повышение концентрации N-концевого промозгового натрийуретического пептида (NT-proBNP) >900 пг/мл у больных 50-75 лет и >1800 пг/мл у больных >75 лет.
Критерии включения в контрольную группу: пациенты в возрасте от 50 до 90 лет, подписавшие информированное согласие, с установленным диагнозом ХСНсФВ без признаков острой декомпенсации.
Исследование было проведено в соответствии с критериями Хельсинкской декларации. Оно получило одобрение локального этического комитета ФГБУ "НМИЦ терапии и профилактической медицины" Минздрава России (протокол № 04-05/23 от 18.09.2023г). Проект, в рамках которого осуществляется данное исследование, зарегистрирован в системе Clinical.Trials.gov под регистрационным номером NCT06114498.
Пациентам, участвующим в исследовании, выполнялась трансторакальная эхокардиография по стандартному протоколу с измерением следующих параметров: фракция выброса левого желудочка (%) по Симпсону, индекс массы миокарда левого желудочка (г/м2), относительная толщина стенок левого желудочка (мм), отношение максимальных скоростей раннего и позднего наполнения трансмитрального кровотока (E/A), отношение максимальных скоростей раннего наполнения трансмитрального кровотока и движения фиброзного кольца митрального клапана в раннюю диастолу (E/e'), индекс объема левого предсердия (мм/м2).
Рутинные лабораторные анализы включали определение уровней NT-proBNP, гемоглобина, креатинина, мочевины, расчет скорости клубочковой фильтрации по формуле Chronic Kidney Disease Epidemiology Collaboration, аланинаминотрансферазы, аспартатаминотрансферазы, общего билирубина и калия. Клинический анализ крови проводился на гематологическом анализаторе BC-6800 Plus (Mindray, Китай), биохимические исследования выполнялись на анализаторе BS-800M1 (Mindray, Китай). Концентрация NT-proBNP в сыворотке крови определялась на анализаторе Maglumi 2000 (Snibe, Китай).
Взятие крови осуществлялось вакуумной системой Monovette Serum S (Sardstedt, Германия) из кубитальной вены до какого-либо терапевтического вмешательства. Через 30 мин после забора крови она центрифугировалась c ускорением 2000 g в течение 10 мин, после этого сыворотка крови аликвотировалась в 4 пластиковые криопробирки по 800 мкл и передавалась на ответственное хранение в "Банк биологического материала" ФГБУ "НМИЦ ТПМ" Минздрава России. Уровни БТШ определяли методом иммуноферментного анализа: БТШ27 — с использованием стандартизованной тест-системы Human Heat Shock Protein 27 AssayMax ELISA Kit (Assay Pro, США), квБТШ и БТШ70 — с помощью наборов реагентов компании Cloud-Clone (КНР): ELISA Kit for Heat Shock Protein Beta 7 и ELISA Kit for Heat Shock Protein 70. Аналитическая чувствительность наборов полностью соответствовала для количественного определения БТШ в сыворотке крови; так минимальная определяемая концентрации для БТШ27 составила 0,16 нг/мл, БТШ70 — 1,33 нг/мл, квБТШ — 122 пг/мл. Определение всех аналитов осуществлялась в нативной сыворотке без дополнительных разведений. Исследование проводилось в полуавтоматическом режиме с промывкой иммуноферментных микропланшет на вошере Anthos Fluido (Biochrom, Великобритания), с инкубацией согласно указанному производителем режиму на термошейкере PST-60HL (Biosan/Вектор-Бест, Латвия/Россия). Регистрация финальной адсорбции выполнялась с использованием микропланшетного ридера Multiskan FC (Thermo, США) на длине волны 450 нм (референсная длина 620 нм), проходящего ежегодные метрологические проверки. Калибровка и расчет концентраций БТШ осуществлялись с применением программного обеспечения анализатора SkanIt RE 7.0.2 (Thermo Fisher Scientific, США), результаты калибровки и вычислений проверялись с помощью стороннего калибровочного калькулятора Arigobio GainData (Китай).
Больные ХСНсФВ получали лечение основного и сопутствующих заболеваний согласно актуальным клиническим рекомендациям [22]. В группе ОДСНсФВ на момент поступления пациенты получали: блокаторы ренин-ангиотензин-альдостероновой системы — 89,17%, ингибиторы натрий-глюкозного котранспортера 2 типа — 10,08%, пероральные антикоагулянты — 50,83%, β-адреноблокаторы — 55,83% и антагонисты минералокортикоидных рецепторов (15,83%). В стационаре проводилась в/в терапия фуросемидом в дозировке 40-400 мг/сут. в зависимости от тяжести заболевания у 90,83% больных, остальные 9,17% больных получали пероральную терапию диуретиками. В группе пациентов с компенсированной ХСНсФВ также большинство пациентов получали блокаторы ренин-ангиотензин-альдостероновой системы — 95,0% и β-адреноблокаторы — 90,0%, диуретики — 55,0%, пероральные антикоагулянты — 40,0%, антагонисты минералокортикоидных рецепторов и антиагреганты — 20,0%. Перед выпиской из стационара пациентам назначалась терапия, соответствующая актуальным клиническим рекомендациям согласно имеющимся заболеваниям. Через полгода с момента первого контакта и взятия образцов сыворотки крови проводилось уточнение жизненного статуса пациента. С этой целью использовался специальный скрипт (анкета), которая заполнялась во время телефонного контакта с пациентом или его родственником. В случае невозможности установить контакт с пациентом или его родственником, использовались данные из Единой медицинской информационно-аналитической системы (ЕМИАС). В качестве первичной конечной точки исследования была выбрана смерть от всех причин. Из 120 пациентов, включенных в исследование, конечной точки исследования через 6 мес. наблюдения достиг 21, из них 18 случаев смерти по причине повторной ОДСНсФВ, 2 — по причине острой недостаточности мозгового кровообращения и 1 случай смерти от новой коронавирусной инфекции. Частота отклика в исследовании составила 90%. Все пациенты наблюдались до 6 мес. (±10 дней), у части пациентов конечная точка достигалась ранее, а по части больных были получены данные о жизненном статусе через 1,5 года, таким образом, медиана периода наблюдения составила 183 дня.
Статистический анализ полученных результатов проводился в программе Statistica 10 (Statsoft) и SPSS (IBM). Для попарного сравнения непрерывных (количественных) переменных применялся непараметрический метод Манна-Уитни. Сравнение различий частот категориальных переменных анализировалось с использованием двухстороннего точного критерия Фишера. Для оценки потенциальной эффективности биомаркеров проводилось построение графиков чувствительности в зависимости от значения (1-специфичность) с использованием ROC-анализа (Receiver operating characteristic), включающего расчет площади под кривой (AUC — area under curve) и выбор оптимальных пороговых уровней с использованием максимального коэффициента Юдена (Jmax). Анализ выживаемости проводился методом построения кривых Каплан-Мейера (Kaplan-Mayer) с оценкой различий с применением логрангового критерия (Log-rank). Для анализа потенциальных факторов, ассоциированных со снижением выживаемости, дополнительно проводился регрессионный анализ с помощью модели пропорциональных рисков Кокса (Cox hazards regression model) c расчетом отношения рисков (HR — hazard ratio). Различия считались статистически значимыми при p<0,05.
Результаты
Концентрации БТШ были определены в сыворотке крови 140 больных. У пациентов с ОДСНсФВ медианы уровня БТШ70 и квБТШ в сыворотке крови были статистически значимо выше, чем у пациентов с компенсированной ХСНсФВ (3,17 vs 2,08 нг/мл, p=0,001) и квБТШ (1068 vs 614 пг/мл, p=0,001), тогда как различия по уровню БТШ27 статистической значимости не достигли (табл. 1).
Для анализа взаимосвязи концентраций циркулирующих БТШ с исходами ОДСНсФВ было проведено сравнение исходных уровней (полученных в крови, взятой при первом наблюдении) анализируемых БТШ в группе больных с ОДСНсФВ в зависимости от жизненного статуса, оценённого через 6 мес. Исходная медиана концентрации БТШ27 у больных, достигших конечной точки, составила 1,30 [ 0,41-4,58] vs 0,77 [ 0,33-2,76] нг/мл в группе выживших, однако различия не достигли статистической значимости (p=0,4). Не было выявлено статистически значимых различий и по медиане квБТШ — 1117 [ 928-1378] vs 1039 [ 905-1185] пг/мл (p=0,29) между группами умерших и выживших. В то же время по исходным сывороточным концентрациям высокомолекулярного БТШ70 были обнаружены статистически значимые различия между группой больных, достигших конечной точки, — 4,15 [ 3,11-6,09] нг/мл и группой выживших — 2,89 [ 2,09-4,57] нг/мл, p=0,005. Для расчета пороговых уровней БТШ, которые были использованы в дальнейшем анализе выживаемости, был проведен ROC анализ (рис. 1).
Наибольшая AUC была характерна для БТШ70, тогда как для других биомаркеров AUC была существенно ниже. Полученные с использованием максимального индекса Юдена пороговые уровни составили для БТШ27 — 0,72 нг/мл (Jmax =0,161), для БТШ70 — 3,5 нг/мл (Jmax =0,323), квБТШ — 1321 пг/мл (Jmax =0,243).
С целью учета неполных (цензурированных) наблюдений нами проводился анализ выживаемости методом Каплана-Мейера, который показал наличие статистически значимых различий кумулятивной пропорциональной выживаемости больных ОДСНсФВ в зависимости от рассчитанных пороговых значений для БТШ70 (p log-rank =0,008) (рис. 2). Выживаемость больных ОДСНсФВ с исходным уровнем БТШ70 ≤3,5 нг/мл составила 90,7% на сроке 3 мес. и 87,3% на сроке 6 мес., тогда как у больных с гиперсекрецией БТШ70 >3,5 н/мл прогноз был менее благоприятный — выживаемость на сроке 3 мес. — 77,6%, на сроке 6 меc. — 72,4%.
Для БТШ27 статистически значимых различий при анализе выживаемости получено не было (p log-rank =0,17), тогда как для квБТШ были выявлены статистически значимые различия (p log-rank =0,011) выживаемости в зависимости от уровней маркера (рис. 3). Так, 3- и 6-месячная выживаемость у больных с уровнем квБТШ ≤1321 пг/мл составила 88,1 и 85,2%, соответственно, тогда как в группе с высокими концентрациями квБТШ >1321 пг/мл кумулятивная пропорциональная выживаемость на данных сроках была ниже и составила, соответственно, 70,0 и 59,5%.
Регрессионный анализ с использованием модели Кокса, включающий ряд клинических факторов и уровни БТШ (табл. 2), также показал, что факторами прогноза, статистически значимо ассоциированными со снижением выживаемости больных ОДСНсФВ, являются повышенный уровень БТШ70: HR [ 95% доверительный интервал (ДИ)] =3,95 [ 1,13-13,78], p=0,031 и квБТШ: HR [ 95% ДИ] =3,50 [ 1,11-11,06], p=0,033, а также индекс массы тела (ИМТ): HR [ 95% ДИ] =1,03 [ 1,02-1,06], p=0,038.
Как видно из таблицы 2, в число значимых переменных в модель вошли БТШ70 и квБТШ и ИМТ, однако HR для ИМТ оказалось достаточно низким.
Таблица 1
Клинико-анамнестическая, инструментальная и лабораторная характеристика исследуемых больных
|
Показатель |
Основная группа: |
Контрольная группа: |
p |
|
Общая характеристика больных |
|||
|
Возраст, лет (Me [Q25-Q75]) |
77,0 [ 69,0-85,0] |
73,0 [ 69,0-77,0] |
0,07 |
|
Мужчины, n (%) Женщины, n (%) |
34 (28,3) 84 (77,7) |
4 (20,0) 16 (80,0) |
0,310 |
|
Ожирение — ИМТ >30 кг/м2, n (%) |
65 (54,2) |
9 (45,0) |
0,300 |
|
ИМТ, кг/м2; Me [Q25-Q75] |
30,6 [ 26,8-35,9] |
29,7 [ 27,7-32,7] |
0,510 |
|
ФП, n (%) |
73 (60,8) |
9 (45,0) |
0,140 |
|
Частота отклика через 6 мес., % |
90 |
— |
— |
|
Жизненный статус через 6 мес.: летальный исход, n (%) |
21 (17,5) |
— |
— |
|
Результаты ЭхоКГ, Me [Q25-Q75] |
|||
|
ФВ ЛЖ (по Симпсону), % |
56,0 [ 53,0-59,0] |
64,5 [ 60,5-66,5] |
0,001 |
|
иММЛЖ, г/м2 |
116,0 [ 102,0-116,0] |
111,5 [ 98,5-123,5] |
0,230 |
|
ОТС ЛЖ, мм |
0,55 [ 0,51-0,59] |
0,46 [ 0,41-0,49] |
0,001 |
|
E/A |
0,86 [ 0,78-1,13] |
0,87 [ 0,75-1,07] |
0,850 |
|
E/e' |
14,3 [ 12,4-16,0] |
13,1 [ 13,0-14,0] |
0,110 |
|
Индекс объема ЛП, мм/м2 |
42,0 [ 39,0-47,0] |
37,0 [ 35,0-44,5] |
0,049 |
|
Результаты лабораторных исследований, Me [Q25-Q75] |
|||
|
NT-proBNP, пг/мл |
1717 [ 947-4395] |
265 [ 141-405] |
0,001 |
|
Гемоглобин, г/л |
121 [ 101-136] |
138 [ 134-144] |
0,007 |
|
Креатинин, мкмоль/л |
105 [ 79,1-131] |
70,0 [ 65,5-85,0] |
0,001 |
|
Мочевина, ммоль/л |
8,6 [ 6,4-13,0] |
6,9 [ 4,8-7,3] |
0,01 |
|
СКФ, CKD-EPI, мл/мин |
55,0 [ 38,0-70,0] |
74,5 [ 65,5-80,0] |
0,001 |
|
АЛТ, Ед/л |
22,0 [ 14,5-36,9] |
20,0 [ 14,0-22,0] |
0,110 |
|
АСТ, Ед/л |
21,7 [ 17,2-35,4] |
21,0 [ 17,5-23,5] |
0,240 |
|
Общий билирубин, мкмоль/л |
10,2 [ 7,5-18,3] |
13,5 [ 10,5-22,5] |
0,190 |
|
Калий, ммоль/л |
4,15 [ 3,87-4,70] |
4,35 [ 4,05-4,50] |
0,710 |
|
Уровни циркулирующих БТШ, Me [Q25-Q75] |
|||
|
БТШ27, нг/мл |
0,99 [ 0,34-2,89] |
0,56 [ 0,11-1,26] |
0,05 |
|
БТШ70, нг/мл |
3,17 [ 2,18-4,87] |
2,08 [ 1,69-2,50] |
0,001 |
|
квБТШ, пг/мл |
1068 [ 931-1222] |
614 [ 551-781] |
0,001 |
Сокращения: АЛТ — аланинаминотрансфераза, АСТ — аспартатаминотрансфераза, БТШ — белок теплового шока, иММЛЖ — индекс массы миокарда левого желудочка, ИМТ — индекс массы тела, квБТШ — кардиоваскулярный белок теплового шока, ЛП — левое предсердие, ОДСНсФВ — острая декомпенсация сердечной недостаточности с сохраненной фракцией выброса, ОТС ЛЖ — относительная толщина стенок левого желудочка, СКФ по CKD-EPI — скорость клубочковой фильтрации по формуле Chronic Kidney Disease Epidemiology Collaboration, ФВ ЛЖ — фракция выброса левого желудочка, ФП — фибрилляция предсердий, ЭхоКГ — эхокардиография, E/A — отношение максимальных скоростей раннего и позднего наполнения трансмитрального кровотока, E/e' — отношение максимальных скоростей раннего наполнения трансмитрального кровотока и движения фиброзного кольца митрального клапана в раннюю диастолу, Me [Q25-Q75]) — медиана [интерквартильный размах], NT-proBNP — N-концевой промозговой натрийуретический пептид.
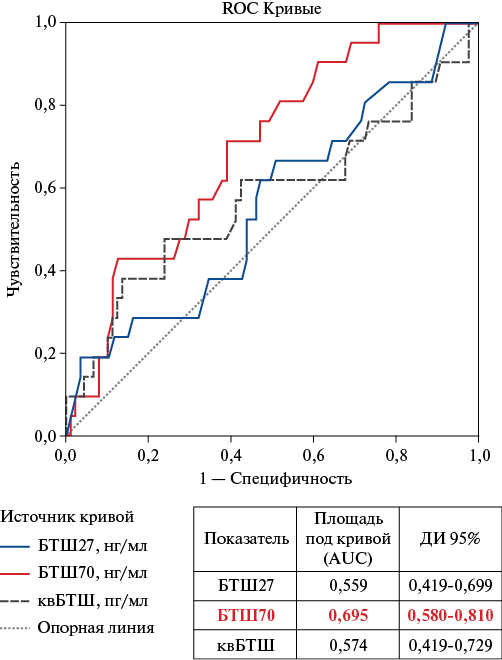
Рис. 1. Результаты ROC-анализа сравнения больных ХСНсФВ в зависимости от исходов (умершие vs выжившие на срок 6 мес.).
Сокращения: БТШ — белок теплового шока, ДИ — 95% доверительный интервал, квБТШ — кардиоваскулярный белок теплового шока, AUC — площадь под кривой (area under curve), ROC-кривая — Receiver Operator Characteristic.
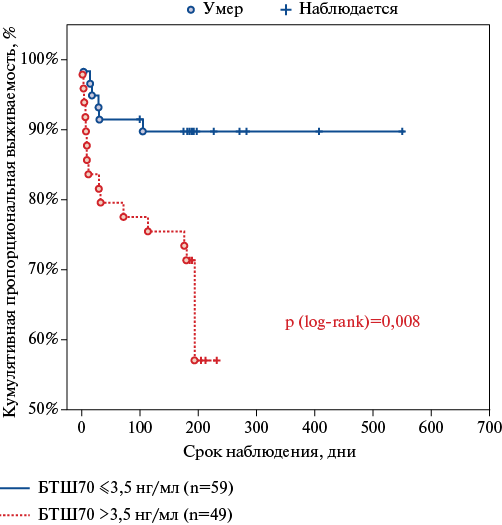
Рис. 2. Кривые выживаемости больных после острой декомпенсации ХСНсФВ в зависимости от исходного уровня БТШ70.
Сокращения: БТШ — белок теплового шока, log-rank — непараметрический критерий, используемый для сравнения двух кривых выживаемости.
Таблица 2
Результаты анализа пропорциональных рисков Кокса у больных, перенесших ОДСНсФВ
|
Переменные в модели Кокса |
HR (95,0% ДИ) |
p |
|
Возраст, лет |
0,988 (0,937-1,042) |
0,665 |
|
ИМТ, кг/м2 |
1,031 (1,002-1,062) |
0,038 |
|
Сахарный диабет 2 типа (есть/нет) |
1,433 (0,510-4,028) |
0,495 |
|
ИБС (есть/нет) |
2,195 (0,559-8,619) |
0,260 |
|
Окружность талии, см |
1,000 (0,948-1,055) |
0,997 |
|
Окружность бедер, см |
1,014 (0,958-1,074) |
0,630 |
|
Отеки нижних конечностей (есть/нет) |
4,208 (0,488-36,303) |
0,191 |
|
Ортопноэ (есть/нет) |
5,097 (0,611-42,497) |
0,132 |
|
БТШ27 (высокий/низкий) |
1,592 (0,501-5,060) |
0,431 |
|
БТШ70 (высокий/низкий) |
3,947 (1,130-13,784) |
0,031 |
|
квБТШ (высокий/низкий) |
3,502 (1,109-11,063) |
0,033 |
|
ФВ ЛЖ, % (Simpson) |
0,942 (0,834-1,064) |
0,337 |
|
Толщина эпикардиального жира, мм |
0,850 (0,611-1,181) |
0,333 |
Сокращения: ДИ — доверительный интервал, ИБС — ишемическая болезнь сердца, ИМТ — индекс массы тела, БТШ — белок теплового шока, квБТШ — кардиоваскулярный белок теплового шока, ФВ ЛЖ — фракция выброса левого желудочка, HR — hazard ratio, отношение рисков, для отношения интенсивностей риска в экспериментальной и контрольной группах.
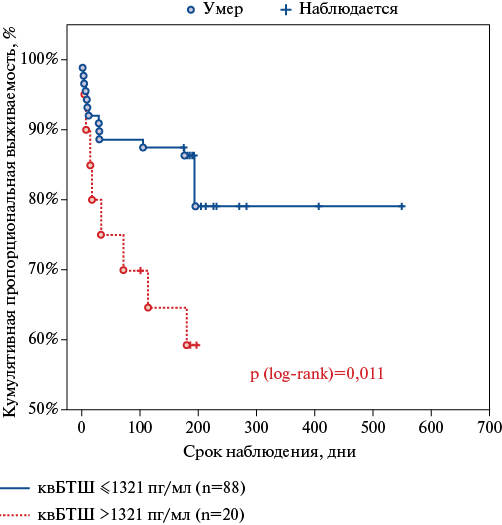
Рис. 3. Кривые выживаемости больных после ОДСНсФВ в зависимости от исходного уровня квБТШ.
Сокращения: квБТШ — кардиоваскулярный белок теплового шока, log-rank — непараметрический критерий, используемый для сравнения двух кривых выживаемости.
Обсуждение
Сердечная недостаточность — заболевание со сложной и не до конца изученной патофизиологией. За последние десятилетия наше понимание ключевых механизмов, участвующих в развитии и прогрессировании СН, эволюционировало от "простой" гемодинамической проблемы через нейрогормональные нарушения и воспалительные процессы до сложной мультиорганной дисфункции, сопровождающейся недостаточной перфузией органов и систем. Именно поэтому в настоящее время актуален поиск новых биомолекул, которые могут представлять ценность для стратификации риска, раннего выявления, и прогнозирования осложнений течения заболевания, однако реальное клиническое значение имеют лишь немногие из них.
В рамках настоящей работы проанализирован комплекс БТШ, характеризующих системный биохимический ответ на клеточный стресс у больных с ОДСНсФВ. Исследование является продолжением нашей предыдущей работы, в которой изучался комплекс БТШ27, БТШ70 и квБТШ в сыворотке крови у пациентов при компенсированной ХСНсФВ и ОДСНсФВ, в котором, однако, не оценивалось прогностическое значение БТШ. Так, в работе [23] было показано, что концентрации БТШ у пациентов с ОДСНсФВ статистически значимо выше, чем у стабильных пациентов с ХСНсФВ; была выявлена прямая связь выраженности венозного застоя с уровнями БТШ27 и квБТШ.
Среди близких по тематике работ отдельного внимания заслуживает исследование Traxler D, et al., в котором оценивали уровень циркулирующего БТШ27 в плазме крови у пациентов со стабильной СН [24]. Результаты показали, что БТШ27 является независимым предиктором сердечно-сосудистой смерти или незапланированной госпитализации, связанной с СН, при уровне БТШ27, превышающем медиану 3820 пг/мл. Уровни БТШ27 у пациентов, перенесших сердечно-сосудистые события, составили 4214 пг/мл, в то время как у больных без таких событий они были значительно ниже — 3444 пг/мл. Стоит отметить, что в настоящем исследовании статистически значимых различий в зависимости от исхода заболевания и исходной концентрацией БТШ27 получено не было. В то же время, в отличие от исследования [24], мы анализировали не все фенотипы СН, а только ХСНсФВ. В ряде работ изучали связь уровней циркулирующих БТШ с ФП. Так, в исследовании, проведенном Hu YF, et al., было показано, что более высокий уровень БТШ27 был фактором, который ассоциировался с поддержанием синусового ритма после проведенной катетерной аблации [25]. В другом исследовании сывороточные уровни БТШ27, БТШ70, квБТШ у пациентов с различными формами ФП, обратившихся для проведения электрической кардиоверсии или катетерной аблации, анализировались до вмешательства и через 3, 6 и 12 мес. после него. Связи между исходными уровнями БТШ27, БТШ70, квБТШ и наличием ФП, стадией ФП или вероятностью рецидива ФП выявить не удалось, однако уровень БТШ27 был повышен в образцах сыворотки пациентов с рецидивом ФП в течение года после оперативного вмешательства; это позволило авторам предположить, что уровень БТШ27 может предсказывать рецидив ФП после катетерного лечения [26].
В ряде работ оценивали прогностический потенциал БТШ70. Так, в исследовании Rigopoulos AG, et al. изучали взаимосвязь циркулирующего БТШ70 с рецидивом симптоматической ФП в течение 1 года. Показано, что повышенный уровень БТШ70 с пороговым значением ≥0,65 нг/мл оказался независимым фактором, связанным с рецидивом ФП [27]. В другой работе, проведенной Desai SR, et al., оценивался 5-летний риск смерти от всех причин, от сердечно-сосудистых причин и риск нефатального инфаркта миокарда у пациентов с ишемической болезнью сердца (ИБС). Модель прогнозирования риска включала 6 биомаркеров, в т. ч. и БТШ70. Уровень БТШ70 >11,3 нг/мл был связан с более высокой частотой развития нежелательных событий. Авторы подчёркивают, что интеграция нескольких биомаркеров с клиническими переменными улучшает оценку сердечно-сосудистого риска у пациентов с ИБС [28]. Данный результат согласуется с нашими данными, однако следует отметить, что в настоящей работе исследовалась более узкая группа пациентов, а именно, с ОДСНсФВ. Полученное нами пороговое значение 3,5 нг/мл для БТШ70 ниже, чем в упомянутой работе [28], что может быть связано как с различиями используемых тест-систем, различиями в диагнозах исследуемых больных — в нашем исследовании это была группа больных ОДСНсФВ, тогда как в исследовании Rigopoulos AG, et al. были пациенты с ФП без сопутствующих заболеваний, которые могли осложнить течение ФП, таких как ИБС, хроническая или острая СН. Таким образом, в литературе описан ряд ассоциаций БТШ с наличием заболевания, тяжестью и прогнозом течения ряда сердечно-сосудистых заболеваний; в то же время нами при исследовании БТШ70, БТШ27 и квБТШ в группе больных ОДСНсФВ впервые была показана связь гиперсекреции БТШ70 и квБТШ с неблагоприятным прогнозом в отношении выживаемости после ОДСНсФВ.
Ограничения исследования. Настоящая работа носит пилотный характер и имеет ряд ограничений, включающих относительно небольшой объем выборки и малую продолжительность наблюдения. Отклик исследования достаточно высок (90%), однако часть пациентов через 6 мес. на контакт не вышла. В качестве первичной конечной точки была выбрана смерть от всех причин. Данный показатель включает в себя как смерть от сердечно-сосудистой патологии, так и от любых других причин, что требует дополнительных исследований с бóльшим объемом выборки с дифференцировкой причин смерти.
Заключение
Проведенный анализ показал различия в сывороточных уровнях БТШ70 и квБТШ у больных с компенсированной ХСНсФВ и ОДСНсФВ. При этом у больных с ОДСНсФВ повышенные уровни БТШ70 >3,5 нг/мл и квБТШ >1321 пг/мл были ассоциированы с неблагоприятным прогнозом в отношении смерти от всех причин. Полученные в настоящей работе результаты демонстрируют, что гиперсекреция БТШ в кровоток может свидетельствовать о декомпенсации заболевания, его неблагоприятном течении, что предположительно может быть связано с выраженностью ответа на клеточный стресс, возникающий при повреждении внутриклеточных структур в результате хронического воспаления и тканевой гипоксии, играющих роль в патогенезе ХСНсФВ.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Список литературы
1. Liu M, Fang F, Yu C-M. Noncardiac Comorbidities in Heart Failure With preserved ejection fraction — commonly ignored fact. Circ J. 2015;79(5):954-9. doi:10.1253/circj.CJ-15-0056.
2. Heidenreich PA, Albert NM, Allen LA, et al. American Heart Association Advocacy Coordinating Committee; Council on Arteriosclerosis, Thrombosis and Vascular Biology; Council on Cardiovascular Radiology and Intervention; Council on Clinical Cardiology; Council on Epidemiology and Prevention; Stroke Council. Forecasting the impact of heart failure in the United States: a policy statement from the American Heart Association. Circ Heart Fail. 2013;6(3):606-19. doi:10.1161/HHF.0b013e318291329a.
3. Поляков Д.С., Фомин И.В., Беленков Ю.Н. и др. Хроническая сердечная недостаточность в Российской Федерации: что изменилось за 20 лет наблюдения? Результаты исследования ЭПОХА—ХСН. Кардиология. 2021;61(4):4-14. doi:10.18087/cardio.2021.4.n1628.
4. Виноградова Н.Г., Поляков Д.С., Фомин И.В. Риски повторной госпитализации пациентов с ХСН при длительном наблюдении в специализированном центре лечения ХСН и в реальной клинической практике. Кардиология. 2020;60(3):59-69. doi:10.18087/cardio.2020.3.n1002.
5. Oikonomou E, Vogiatzi G, Tsalamandris S, et al. Non-natriuretic peptide biomarkers in heart failure with preserved and reduced ejection fraction. Biomark Med. 2018;12(7): 783-97. doi:10.2217/bmm-2017-0376.
6. Никифорова Т.А., Щекочихин Д.Ю., Ломоносова А.А. и др. Значение биомаркеров при первой декомпенсации хронической сердечной недостаточности с сохраненной фракцией выброса левого желудочка: результаты двухлетнего наблюдения. Кардиология и сердечно-сосудистая хирургия. 2017;10(6):46-51. doi:10.17116/kardio201710646-51.
7. Иванова А.А., Джиоева О.Н., Лавренова Е.А. и др. Сложные вопросы диагностики сердечной недостаточности с сохраненной фракцией выброса: фокус на эхокардиографические исследования. Кардиоваскулярная терапия и профилактика. 2023;22(5):3565. doi:10.15829/1728-8800-2023-3565.
8. Rodríguez-Iturbe B, Johnson RJ. Heat shock proteins and cardiovascular disease. Physiol Int. 2018;105(1):19-37. doi:10.1556/2060.105.2018.1.4.
9. Котова Ю.А., Зуйкова А.А. Изучение маркров повреждения эндотелия, окислительного и клеточного стресса у больных ИБС и сопутствующим ожирением. Вестник новых медицинских технологий. 2021;28(2):25-8. doi:10.24412/1609-2163-2021-2-25-28.
10. Метельская В.А., Тимофеев Ю.С., Нешкова Е.А. и др. Воспалительное старение. Часть 1. Основные биохимические механизмы. Профилактическая медицина. 2024;27(12):145-50. doi:10.17116/profmed202427121145.
11. Hu C, Yang J, Qi Z, et al. Heat shock proteins: Biological functions, pathological roles, and therapeutic opportunities. MedComm (2020). 2022;3(3):e161. doi:10.1002/mco2.161.
12. Drapkina OM. The specific features of synthesis of heat shock proteins in patients with postinfarct cardiosclerosis. Klin Med (Mosk). 2004;82(9):25-8.
13. Zhou B, Tian R. Mitochondrial dysfunction in pathophysiology of heart failure. J Clin Invest. 2018;128(9):3716-26. doi:10.1172/JCI120849.
14. Ганковская Л.В., Понасенко О.А., Свитич О.А. Роль белка теплового шока 70 в патогенезе сердечнососудистой патологии. Медицинская иммунология. 2019;21(2):201-8. doi:10.15789/1563-0625-2019-2-201-208.
15. Shan Q, Ma F, Wei J, et al. Physiological Functions of Heat Shock Proteins. Curr Protein Pept Sci. 2020;21(8):751-60. doi:10.2174/1389203720666191111113726.
16. Dubrez L, Causse S, Borges Bonan N, et al. Heat-shock proteins: chaperoning DNA repair. Oncogene. 2020;39(3):516-29. doi:10.1038/s41388-019-1016-y.
17. Sklifasovskaya AP, Blagonravov M, Ryabinina A, et al. The role of heat shock proteins in the pathogenesis of heart failure (Review). Int J Mol Med. 2023;52(5):106. doi:10.3892/ijmm.2023.5309.
18. Kovács D, Kovács M, Ahmed S, et al. Functional diversification of heat shock factors. Biol Futur. 2022;73(4):427-39. doi:10.1007/s42977-022-00138-z.
19. Kurop MK, Huyen CM, Kelly JH, et al. The heat shock response and small molecule regulators. Eur J Med Chem. 2021;226:113846. doi:10.1016/j.ejmech.2021.113846.
20. Muranova LK, Shatov VM, Gusev NB. Role of Small Heat Shock Proteins in the Remodeling of Actin Microfilaments. Biochemistry (Mosc). 2022;87(8):800-11. doi:10.1134/S0006297922080119.
21. Wu T, Mu Y, Bogomolovas J, et al. HSPB7 is indispensable for heart development by modulating actin filament assembly. Proc Natl Acad Sci USA. 2017;114(45):11956-61. doi:10.1073/pnas.1713763114.
22. Хроническая сердечная недостаточность. Клинические рекомендации 2020. Российский кардиологический журнал. 2020;25(11): 4083. doi:10.15829/1560-4071-2020-4083.
23. Тимофеев Ю.С., Афаунова А.Р., Иванова А.А. и др. Связь сывороточных уровней белков теплового шока с выраженностью венозного застоя у пациентов с острой декомпенсацией сердечной недостаточности с сохраненной фракцией выброса. Кардиоваскулярная терапия и профилактика. 2024;23(6):4037. doi:10.15829/1728-8800-2024-4037.
24. Traxler D, Lainscak M, Simader E, et al. Heat shock protein 27 acts as a predictor of prognosis in chronic heart failure patients. Clin Chim Acta. 2017;473:127-32. doi:10.1016/j.cca.2017.08.028.
25. Hu YF, Yeh HI, Tsao HM, et al. Electrophysiological correlation and prognostic impact of heat shock protein 27 in atrial fibrillation. Circ Arrhythm Electrophysiol. 2012;5(2): 334-40. doi:10.1161/CIRCEP.111.965996.
26. Marion DMSV, Lanters EAH, Ramos KS, et al. Evaluating Serum Heat Shock Protein Levels as Novel Biomarkers for Atrial Fibrillation. Cells. 2020;16;9(9):2105. doi:10.3390/cells9092105.
27. Rigopoulos AG, Kalogeropoulos AS, Tsoporis JN, et al. Heat Shock Protein 70 Is Associated With Cardioversion Outcome and Recurrence of Symptomatic Recent Onset Atrial Fibrillation in Hypertensive Patients. J Cardiovasc Pharmacol. 2021;77(3):360-9. doi:10.1097/FJC.0000000000000962.
28. Desai SR, Dhindsa DS, Ko YA, et al. Aggregate Clinical and Biomarker-Based Model Predicts Adverse Outcomes in Patients With Coronary Artery Disease. Am J Cardiol. 2023;203:315-24. doi:10.1016/j.amjcard.2023.06.115.
Об авторах
Ю. С. ТимофеевРоссия
Тимофеев Юрий Сергеевич — к.м.н., с.н.с., руководитель лаборатории изучения биохимических маркеров риска хронических неинфекционных заболеваний им. Н. В. Перовой отдела фундаментальных и прикладных аспектов ожирения
Москва
Т. Ю. Веденикин
Россия
Веденикин Тимофей Юрьевич — зав. отделением анестезиологии-реанимации № 03 для лечения больных кардиологического профиля
Москва
А. Р. Афаунова
Россия
Афаунова Алина Руслановна — аспирант, отдел фундаментальных и прикладных аспектов ожирения
Москва
Р. А. Замятин
Россия
Замятин Роман Александрович — аспирант, отдел фундаментальных и прикладных аспектов ожирения
Москва
В. Н. Метельская
Россия
Метельская Виктория Николаевна — д.б.н., профессор, г.н.с. лаборатории изучения биохимических маркеров риска хронических неинфекционных заболеваний им. Н. В. Перовой отдела фундаментальных и прикладных аспектов ожирения
Москва
О. Н. Джиоева
Россия
Джиоева Ольга Николаевна — д.м.н., в.н.с. отдела фундаментальных и прикладных аспектов ожирения
Москва
А. А. Иванова
Россия
Иванова Анна Александровна — м.н.с. отдела фундаментальных и прикладных аспектов ожирения
Москва
Е. А. Нешкова
Россия
Нешкова Елена Андреевна — н.с. лаборатории изучения биохимических маркеров риска хронических неинфекционных заболеваний им. Н. В. Перовой отдела фундаментальных и прикладных аспектов ожирения
Москва
М. С. Покровская
Россия
Покровская Мария Сергеевна — к.б.н., в.н.с. лаборатории Банк биологического материала
Москва
О. М. Драпкина
Россия
Драпкина Оксана Михайловна — д.м.н., профессор, академик РАН, директор, главный внештатный специалист по терапии и общей врачебной практике Минздрава России
Москва
Дополнительные файлы
- Определение уровней белков теплового шока (БТШ) в сыворотке крови используется для биохимической оценки активности клеточного стресса.
- Повышенные концентрации БТШ70 и кардиоваскулярного БТШ (квБТШ) ассоциированы с худшим прогнозом жизни у больных, перенесших острую декомпенсацию ХСНсФВ.
Рецензия
Для цитирования:
Тимофеев Ю.С., Веденикин Т.Ю., Афаунова А.Р., Замятин Р.А., Метельская В.Н., Джиоева О.Н., Иванова А.А., Нешкова Е.А., Покровская М.С., Драпкина О.М. Белки теплового шока в оценке течения и прогноза исходов хронической сердечной недостаточности с сохраненной фракцией выброса. Российский кардиологический журнал. 2025;30(4):6317. https://doi.org/10.15829/1560-4071-2025-6317. EDN: YHFXWZ
For citation:
Timofeev Yu.S., Vedenikin T.Yu., Afaunova A.R., Zamyatin R.A., Metelskaya V.A., Dzhioeva O.N., Ivanova A.A., Neshkova E.A., Pokrovskaya M.S., Drapkina O.M. Heat shock proteins in the assessment of the course and prognosis of heart failure with preserved ejection fraction. Russian Journal of Cardiology. 2025;30(4):6317. (In Russ.) https://doi.org/10.15829/1560-4071-2025-6317. EDN: YHFXWZ

















































