Перейти к:
Время и механизмы развития нарушений проводимости сердца при транскатетерной имплантации аортального клапана: данные интраоперационного холтеровского мониторирования сердечного ритма
https://doi.org/10.15829/1560-4071-2025-6300
EDN: WJFZIA
Аннотация
Цель. Оценить время возникновения и взаимосвязь нарушений проводимости сердца с различными хирургическими этапами транскатетерной имплантации аортального клапана (ТИАК) посредством интраоперационного холтеровского мониторирования (ХМ) сердечного ритма.
Материал и методы. В данное проспективное наблюдательное исследование были включены 60 пациентов с высоким риском нарушений атриовентрикулярной (АВ) проводимости, перенесших ТИАК по поводу выраженного аортального стеноза. Интраоперационная оценка ритма сердца осуществлялась посредством непрерывного ХМ сердечного ритма. После окончания процедуры регистрация сердечного ритма продолжалась в течение последующих 24 ч. Целевые временные промежутки основных хирургических этапов затем сопоставлялись с нарушениями проводимости сердца (транзиторными и/или персистирующими), выявленными при анализе данных электрокардиографического регистратора (АВ-блокада 1 степени, полная АВ-блокада, блокады правой и левой ножек пучка Гиса).
Результаты. Впервые возникшие нарушения проводимости сердца были отмечены у 85,3% пациентов. У 31,2% пациентов нарушения проводимости были отмечены до этапа имплантации биопротеза (позиционирование жесткого проводника, баллонная вальвулопластика), у 23,4% — на этапе имплантации биопротеза, и у 31,5% — непосредственно после этапа баллонной постдилатации. Транзиторный вариант течения был наиболее характерен для полной АВ-блокады, разрешение которой в послеоперационном периоде отмечено в 62,5% случаев. АВ-блокада 1 степени и блокада левой ножки пучка Гиса сохранялись перед выпиской из стационара в 71,4% и 65% случаев, соответственно. Среди транзиторных нарушений проводимости сердца наибольшую продолжительность имела АВ-блокада 1 степени, медиана времени до разрешения которой составила 420 мин.
Заключение. Около трети нарушений проводимости сердца при ТИАК возникают до фактической имплантации биопротеза. Наиболее частым нарушением проводимости сердца после ТИАК является впервые возникшая полная блокада левой ножки пучка Гиса, которая в большинстве случаев носит персистирующий характер и сохраняется к моменту выписки пациента из стационара. Интраоперационное ХМ сердечного ритма при ТИАК может являться важным инструментом для оценки и прогнозирования различных нарушений проводимости сердца, а также определения оптимальной послеоперационной стратегии ведения пациентов.
Ключевые слова
Для цитирования:
Баранов А.А., Быстрицкая О.А., Замараева Е.С., Бадоян А.Г., Хелимский Д.А., Цыденова А.Ю., Перегудов И.С., Филиппенко А.Г., Юсупова М.А., Майнгарт С.В., Федорченко А.Н., Крестьянинов О.В. Время и механизмы развития нарушений проводимости сердца при транскатетерной имплантации аортального клапана: данные интраоперационного холтеровского мониторирования сердечного ритма. Российский кардиологический журнал. 2025;30(4):6300. https://doi.org/10.15829/1560-4071-2025-6300. EDN: WJFZIA
For citation:
Baranov A.A., Bystritskaya O.A., Zamaraeva E.S., Badoyan A.G., Khelimsky D.A., Tsydenova A.Yu., Peregudov I.S., Filippenko A.G., Yusupova M.A., Maingart S.V., Fedorchenko A.N., Krestyaninov O.V. Timing and pathogenesis of heart conduction disorders during transcatheter aortic valve implantation: data of intraoperative Holter monitoring. Russian Journal of Cardiology. 2025;30(4):6300. (In Russ.) https://doi.org/10.15829/1560-4071-2025-6300. EDN: WJFZIA
На сегодняшний день транскатетерная имплантация аортального клапана (ТИАК) является общепризнанной альтернативой для лечения пациентов с выраженным симптоматическим стенозом аортального клапана (АК) независимо от величины хирургического риска [1][2]. Однако по-прежнему одним из важных ограничений данной технологии остается высокая частота послеоперационных нарушений атриовентрикулярной (АВ) и внутрижелудочковой проводимости [3][4]. Выявление различных факторов (предикторов), ассоциируемых с более высоким риском нарушений проводимости сердца и имплантацией постоянного электрокардиостимулятора (ЭКС), позволило разработать ряд эффективных алгоритмов ведения пациентов и более совершенные методики имплантации, что значительно снизило частоту подобных осложнений [5][6]. Тем не менее частота впервые возникшей полной блокады левой ножки пучка Гиса (БЛНПГ) продолжает превышать 20%, а показатель имплантации постоянного ЭКС остается в пределах 10% [7][8]. На сегодняшний день достоверно показано, что развитие данных осложнений после ТИАК ассоциировано с большим спектром неблагоприятных событий, включая не только неуклонное прогрессирование сердечной недостаточности, но и более высокую частоту сердечно-сосудистой и общей смертности [9][10].
Патофизиологические механизмы нарушений проводимости сердца после ТИАК обусловлены тесной связью фиброзного кольца АК с проводящей системой сердца. Механическое повреждение пейсмекерных клеток при этом сопровождается отеком, ишемией, формированием гематомы [11][12]. ТИАК представляет собой сложную и многоэтапную процедуру, включающую, помимо непосредственной имплантации биопротеза, этапы прохождения стенозированного отверстия АК различными проводниками, манипуляции катетерными системами в выходном отделе левого желудочка (ЛЖ), а также баллонную пре- и постдилатацию. Следовательно, развитие различных нарушений проводимости сердца при ТИАК потенциально может быть связано с каждым из вышеупомянутых этапов ТИАК. Понимание данных взаимосвязей может иметь большое значение для планирования операции, прогнозирования и профилактики клинически значимых нарушений проводимости сердца в послеоперационном периоде. Целью представленной работы являлась оценка времени возникновения и взаимосвязи нарушений проводимости сердца с различными хирургическими этапами ТИАК посредством интраоперационного холтеровского мониторирования (ХМ) сердечного ритма.
Материал и методы
В данное проспективное наблюдательное исследование были включены 60 пациентов с высоким риском нарушений АВ-проводимости, которым была выполнена ТИАК по поводу выраженного аортального стеноза в ФГБУ "НМИЦ им. акад. Е. Н. Мешалкина" (Новосибирск) и ГБУЗ "НИИ — ККБ № 1 им. проф. С. В. Очаповского" (Краснодар) в период с апреля 2023г по ноябрь 2024г. Выраженный аортальный стеноз определяли на основании трансторакальной эхокардиографии в соответствии с критериями, отмеченными в действующих рекомендациях Европейского общества кардиологов (англ. European Society of Cardiology, ESC)/Европейской ассоциации кардиоторакальной хирургии (англ. European Association for CardioThoracic Surgery, EACTS) по лечению клапанной болезни сердца: 1) средний градиент ≥40 мм рт.ст. и/или 2) пиковая скорость ≥4,0 м/с [13].
Критериями исходного высокого риска нарушений АВ проводимости являлось наличие как минимум одного из следующих клинико-инструментальных факторов: блокада правой ножки пучка Гиса (БПНПГ); удлинение интервала PQ по электрокардиограмме (ЭКГ) >200 мс; длина мембранозной части межжелудочковой перегородки <5 мм; объем кальцификации левой коронарной створки АК >209 мм3; объем кальцификации выходного отдела ЛЖ в проекции левой коронарной створки >13,7 мм3; возраст >83 лет.
Критериями невключения пациентов в исследование были: имплантация постоянного ЭКС в анамнезе; предшествующая АВ-блокада 2 степени и/или блокада БЛНПГ; иные вмешательства (хирургические, эндоваскулярные) на клапанном аппарате сердца в анамнезе; тип 0 двухстворчатого АК по данным мультиспиральной компьютерной томографии; гемодинамическая или респираторная нестабильность, требующая инотропной поддержки, искусственной вентиляции легких или механической поддержки сердечной деятельности в течение 30 дней до предполагаемого вмешательства.
Всем пациентам, включенным в исследование, выполнялась ЭКГ в 3 стандартных, 3 усиленных униполярных и 6 грудных отведениях. ЭКГ регистрировали на шестиканальном аппарате электрокардиографе Megacart (Simens-Elema AB, Германия). При оценке ЭКГ применяли Миннeсотский код, предложенный Всемирной Организацией Здравоохранения. Определялся ритм, частота сердечных сокращений, наличие нарушений проводимости. Нарушения проводимости сердца определяли в соответствии с Американской кардиологической ассоциацией (American Heart Association)/Фондом Американского колледжа кардиологов (American College of Cardiology Foundation)/Обществом сердечного ритма (Heart Rhythm Society) [14]. Полная БПНПГ определялась при наличии трех ЭКГ-критериев: 1) продолжительность интервала QRS ≥120 мс; 2) наличие комплексов по типу rsr', rsR' или rSR' в отведениях V1 или V2; 3) наличие зубца S большей продолжительностью, чем зубец R, или >40 мс в отведениях I и V6. Наличие полной БЛНПГ подтверждалось наличием следующих ЭКГ-критериев: 1) продолжительность интервала QRS ≥120 мс; 2) наличие широкого зубца R (нередко имеющего "зазубрину" в отведениях I, aVL, V5 и V6); 3) отсутствие зубца q в отведениях I, V5 и V6; 4) продолжительность зубца R >60 мс в отведениях V5 и V6. Запись ЭКГ выполнялась до операции, непосредственно после вмешательства и перед выпиской из стационара. Нарушение проводимости сердца определяли как персистирующее, если оно развилось во время или после процедуры ТИАК и было зафиксировано на ЭКГ при выписке из стационара или через 7 дней после вмешательства.
Во всех случаях при ТИАК использовался трансфеморальный сосудистый доступ. Ангиографический контроль позиционирования биопротеза осуществляли через лучевую артерию с применением диагностического катетера PigTail. Временную электрокардиостимуляцию осуществляли за счет позиционирования временного электрода в полости правого желудочка. Сверхчастая стимуляция сердца проводилась с помощью устройства (Medtronic 5388 Dual Chamber Pacemaker Monitor) в режиме желудочковой стимуляции (VVI) с частотой 190-200 ударов в мин. Выбор типа и размера транскатетерного биопротеза основывался на данных предоперационной мультиспиральной компьютерной томографии. Применялись как саморасширяемые транскатетерные биопротезы (Evolute R//PRO+ (Medtronic Inc., США), AcurateNeo2 (Boston Scientific, США)), так и баллонорасширяемый биопротез MyVal (Meril Life Sciences, Индия). Решение о постдилатации имплантированного биопротеза принимали по результатам интраоперационной ангиографии и эхокардиографии.
Интраоперационная оценка сердечного ритма. Интраоперационно в режиме реального времени фиксировалось точное время начала каждого из хирургических этапов (позиционирование жесткого проводника в полости ЛЖ — этап 1, баллонная вальвулопластика АК — этап 2, позиционирование и имплантация транскатетерного биопротеза — этап 3, баллонная постдилатация — этап 4). Анализ сердечного ритма в послеоперационном периоде осуществлялся на основании ХМ в течение 24 ч после ТИАК, затем — на основании данных стандартной ЭКГ (рис. 1).
Интраоперационная оценка ритма сердца осуществлялась посредством непрерывного ХМ сердечного ритма с помощью 7-канального ЭКГ-регистратора "Кардиотехника 04-3" (ЗАО "ИНКАРТ", Россия). После окончания процедуры регистрация сердечного ритма продолжалась в течение последующих 24 ч. Целевые временные промежутки основных хирургических этапов затем сопоставлялись с нарушениями проводимости сердца (транзиторными и/или персистирующими), выявленными при анализе данных ЭКГ-регистратора (рис. 2). Проводилась регистрация таких нарушений АВ- и внутрижелудочковой проводимости, как АВ-блокада 1 степени, полная АВ-блокада, БПНПГ и БЛНПГ.
Статистический анализ данных. Статистическая обработка данных выполнялась с применением пакета программ IBM SPSS Statistics 25 (США) и пакета R 3.5.0 (Австрия). Количественные данные представлены в виде среднее значение ± среднеквадратическое отклонение для переменных с нормальным распределением и в виде медианы и межквартильного интервала — 25-го и 75-го процентилей для переменных с ненормальным распределением. Качественные переменные были представлены в виде абсолютного количества и доли в процентах от общего. Выполнена проверка всех количественных переменных на соответствие нормальному распределению с помощью критерия Колмогорова-Смирнова. Исследование было одобрено локальными этическими комитетами в ФГБУ "НМИЦ им. акад. Е. Н. Мешалкина" и ГБУЗ "НИИ — ККБ № 1 им. профессора С. В. Очаповского", и соответствует принципам Хельсинкской декларации.

Рис. 1. Форма для регистрации целевых временных промежутков, соответствующих основным хирургическим этапам ТИАК.
Сокращение: ЛЖ — левый желудочек.
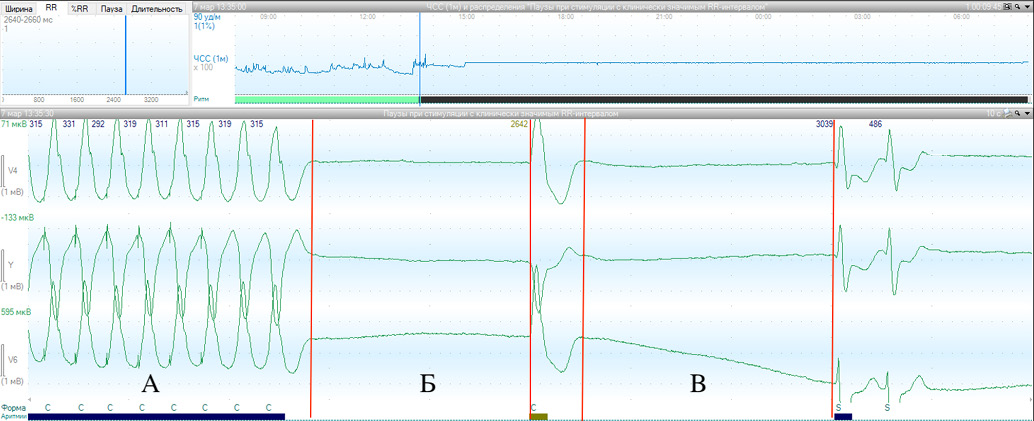
Рис. 2. Клинический пример анализа данных интраоперационного холтеровского мониторирования сердечного ритма.
Примечание: А — эпизод высокочастотной электрокардиостимуляции, соответствующий времени баллонной вальвулопластики АК; Б — эпизод асистолии на фоне далеко зашедшей АВ-блокады продолжительностью 2642 мс; В — эпизод асистолии на фоне далеко зашедшей АВ-блокады продолжительностью 3039 мс.
Результаты
Предоперационная характеристика пациентов представлена в таблице 1. Средний возраст включенных в исследование больных составил 77,1±7,5 лет. Лица мужского пола составили 41,6%. Большинство пациентов имели промежуточный хирургический риск по шкале EuroSCORE II (5,1%), а также низкий хирургический риск по шкале STS-PROM (3,9%).
Инструментальная характеристика включенных больных представлена в таблице 2. Средний градиент давления на АК составил 54,5±14,2 мм рт.ст., фракция выброса ЛЖ — 58,3±7,7. Лица с исходной БПНПГ составили 20%, АВ-блокадой 1 степени — 16,7%.
Процедурные и госпитальные результаты представлены в таблице 3. В исследуемой когорте пациентов был отмечен один случай процедурной летальности, причиной которого была дислокация биопротеза с последующим развитием острой сердечной недостаточности. Частота имплантации постоянного ЭКС на госпитальном этапе составила 8,3%.
Частота впервые возникших нарушений АВ-проводимости при различных этапах ТИАК представлена на рисунке 3. Среди 60 пациентов, перенесших ТИАК, впервые возникшие нарушения проводимости сердца были отмечены у 85,3% пациентов. В 31,2% случаев нарушения проводимости были отмечены до этапа имплантации биопротеза (позиционирование жесткого проводника, баллонная вальвулопластика), в 23,4% случаев — на этапе имплантации биопротеза, и в 31,5% случаев — непосредственно после этапа баллонной постдилатации.
Соотношение транзиторных и персистирующих нарушений АВ-проводимости после ТИАК представлено на рисунке 4. Транзиторный вариант течения был наиболее характерен для полной АВ-блокады, разрешение которой в послеоперационном периоде отмечено в 62,5% случаев. АВ-блокада 1 степени и БЛНПГ сохранялись перед выпиской из стационара в 71,4% и 65% случаев, соответственно.
Среди транзиторных нарушений проводимости сердца наибольшую продолжительность имела АВ-блокада 1 степени, медиана времени до разрешения которой составила 420 мин (табл. 4).
Таблица 1
Предоперационная характеристика пациентов
|
Параметр |
Значение (n=60) |
|
Возраст, лет |
77,1±7,5 |
|
Мужской пол, n (%) |
25 (41,6) |
|
ИМТ, кг/м2 |
31,2±6,4 |
|
ППТ, м2 |
1,93±0,24 |
|
Гипертоническая болезнь, n (%) |
53 (88,3) |
|
Сахарный диабет, n (%) |
20 (33,3) |
|
Фибрилляция предсердий, n (%) |
12 (20,0) |
|
Инсульт/ТИА в анамнезе, n (%) |
15 (25,0) |
|
ПИКС, n (%) |
10 (16,7) |
|
Онкопатология, n (%) |
8 (13,3) |
|
ЧКВ в анамнезе, n (%) |
29 (48,3) |
|
АКШ в анамнезе, n (%) |
7 (11,7) |
|
СКФ, мл/мин/1,73 м2 |
60,7±15,9 |
|
СКФ <60 мл/мин/1,73 м2, n (%) |
30 (50,0) |
|
Постоянный прием бета-блокаторов, n (%) |
49 (81,7) |
|
EuroScore II, % |
5,1±2,7 |
|
STS-PROM, % |
3,9±1,8 |
Сокращения: АК — аортальный клапан, АКШ — аортокоронарное шунтирование, ИМТ — индекс массы тела, ПИКС — постинфарктный кардиосклероз, ППТ — площадь поверхности тела, СКФ — скорость клубочковой фильтрации, ТИА — транзиторная ишемическая атака, ЧКВ — чрескожное коронарное вмешательство.
Таблица 2
Инструментальная характеристика включенных больных
|
Параметр |
Значение (n=60) |
|
Эхокардиографическая характеристика |
|
|
Градиент давления на АК средний, мм рт.ст. |
54,5±14,2 |
|
Площадь отверстия АК, см2 |
0,8 (0,7;1,0) |
|
Фракция выброса ЛЖ, % |
58,3±7,7 |
|
Фракция изменения площади ПЖ, % |
43,7±4,8 |
|
ИММЛЖ, г/м2 |
155,0±3,9 |
|
Аортальная регургитация 2-3 степени, n (%) |
14 (23,3) |
|
Митральная регургитация 2-3 степени, n (%) |
12 (20,0) |
|
Трикуспидальная регургитация 2-3 степени, n (%) |
11 (18,3) |
|
Данные мультиспиральной компьютерной томографии |
|
|
Средний диаметр фиброзного кольца АК, мм |
24,1±2,4 |
|
Периметр фиброзного кольца АК, мм |
76,2±6,4 |
|
Диаметр ВОЛЖ, мм |
23,0±2,4 |
|
Длина мембранозной перегородки, мм |
4,9±1,6 |
|
Электрокардиографическая характеристика |
|
|
Синусовый ритм, n (%) |
48 (80,0) |
|
Частота сердечных сокращений, уд./мин |
67,2±9,4 |
|
Интервал PQ, мс |
186,0±35,3 |
|
QRS, мс |
106,0±18,6 |
|
БПНПГ, n (%) |
12 (20,0) |
|
Удлинение интервала PQ >200 мс, n (%) |
10 (16,7) |
Сокращения: АК — аортальный клапан, БПНПГ — блокада правой ножки пучка Гиса, ВОЛЖ — выходной отдел левого желудочка, ИММЛЖ — индексированная масса миокарда левого желудочка, ЛЖ — левый желудочек, ПЖ — правый желудочек.
Таблица 3
Процедурные и госпитальные результаты
|
Параметр |
Значение (n=60) |
|
|
Тип биопротеза, n (%) |
AcurateNeo2 |
32 (53,3) |
|
Evolute R/PRO+ |
12 (20,0) |
|
|
MyVal |
16 (26,7) |
|
|
Размер биопротеза, n (%) |
23 |
12 (20,0) |
|
25 |
18 (30,0) |
|
|
26 |
10 (16,7) |
|
|
27 |
7 (11,7) |
|
|
29 |
5 (8,3) |
|
|
32 |
7 (11,7) |
|
|
34 |
1 (1,7) |
|
|
Размер биопротеза/диаметр ВОЛЖ |
1,2±0,12 |
|
|
Предилатация, n (%) |
27 (90,0) |
|
|
Диаметр баллона для предилатации/диаметр ВОЛЖ |
0,97±0,03 |
|
|
Постдилатация, n (%) |
43 (70) |
|
|
Глубина имплантации биопротеза, мм |
5,1±1,9 |
|
|
Большое сосудистое осложнение, n (%) |
2 (3,3) |
|
|
Имплантация постоянного ЭКС, n (%) |
5 (8,3) |
|
|
Гемоперикард, n (%) |
1 (1,7) |
|
|
Госпитальная летальность, n (%) |
1 (1,7) |
|
|
Средний трансклапанный градиент давления, мм рт.ст. |
9,8±3,4 |
|
|
Парапротезная регургитация >2 степени, n (%) |
1 (1,7) |
|
|
Фракция выброса ЛЖ после ТИАК, % |
61,6±6,9 |
|
Сокращения: ВОЛЖ — выходной отдел левого желудочка, ЛЖ — левый желудочек, ТИАК — транскатетерная имплантация аортального клапана, ЭКС — электрокардиостимулятор.
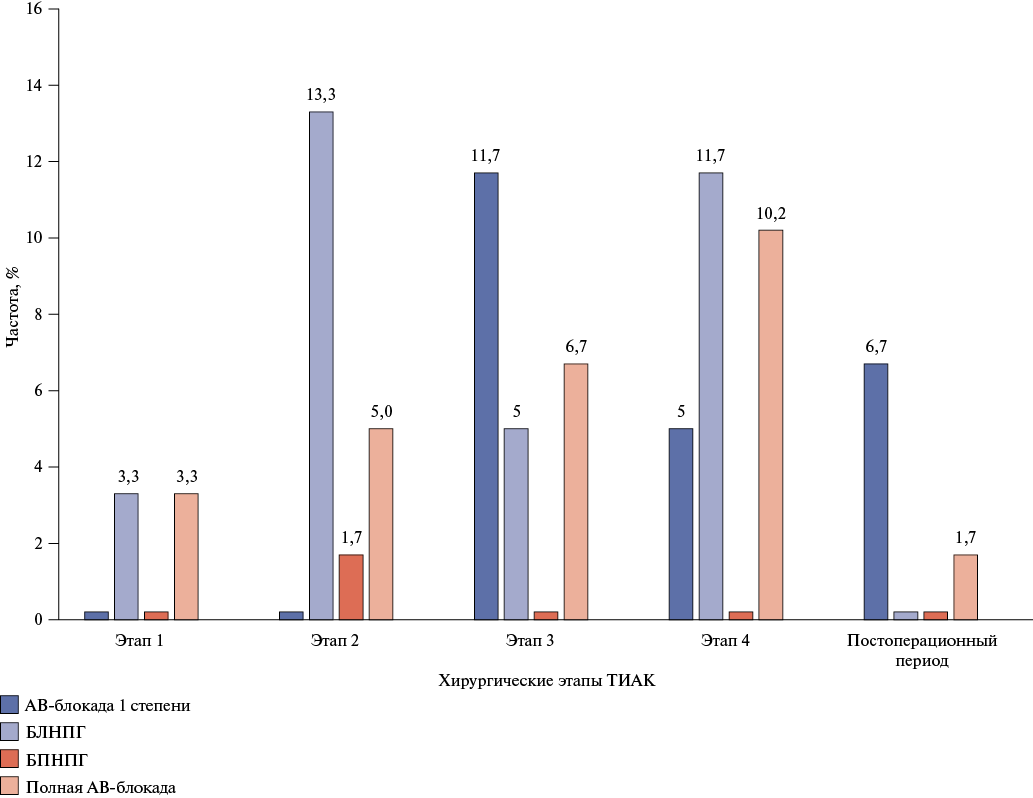
Рис. 3. Частота впервые возникших нарушений АВ-проводимости при различных этапах ТИАК.
Примечание: этап 1 — позиционирование жесткого проводника в полости ЛЖ; этап 2 — баллонная вальвулопластика АК, этап 3 — позиционирование и имплантация транскатетерного биопротеза, этап 4 — баллонная постдилатация биопротеза.
Сокращения: АВ — атриовентрикулярная, АК — аортальный клапан, БЛНПГ — блокада левой ножки пучка Гиса, БПНПГ — блокада правой ножки пучка Гиса, ЛЖ — левый желудочек.
Таблица 4
Продолжительность транзиторных нарушений проводимости сердца при ТИАК по данным холтеровского мониторирования сердечного ритма
|
Вариант транзиторных нарушений проводимости сердца при ТИАК |
Продолжительность, мин |
|
|
Медиана |
Q1-Q3 |
|
|
АВ-блокада 1 степени |
420,0 |
190,0-835,0 |
|
БЛНПГ |
85,5 |
19,8-222,0 |
|
Полная АВ-блокада |
— |
— |
Сокращения: АВ — атриовентрикулярная, БЛНПГ — блокада левой ножки пучка Гиса, БПНПГ — блокада правой ножки пучка Гиса, ТИАК — транскатетерная имплантация аортального клапана.
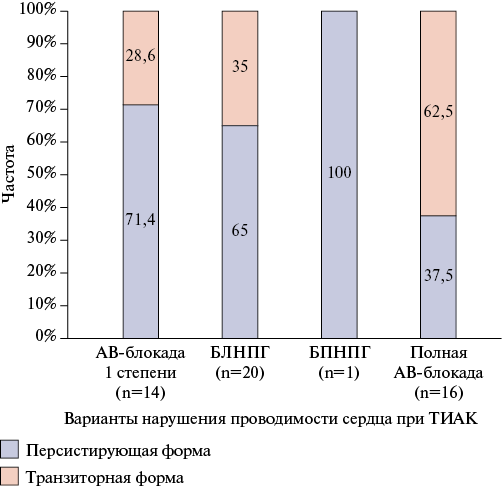
Рис. 4. Частота транзиторных и персистирующих нарушений АВ-проводимости после ТИАК.
Сокращения: АВ — атриовентрикулярная, БЛНПГ — блокада левой ножки пучка Гиса, БПНПГ — блокада правой ножки пучка Гиса, ТИАК — транскатетерная имплантация аортального клапана.
Обсуждение
Результаты представленного исследования следующие: 1) среди 60 пациентов, имеющих исходный высокий риск нарушений АВ-проводимости и перенесших ТИАК биопротезами нового поколения, впервые возникшие нарушения проводимости сердца были отмечены у 85,3% пациентов; 2) большая часть из развившихся нарушений проводимости (90,2%) наблюдалась после одного из этапов ТИАК, при этом 31,2% из них были отмечены до этапа имплантации биопротеза; 3) наиболее частым нарушением проводимости сердца после ТИАК (33,3%) являлась впервые возникшая полная БЛНПГ, которая в 65% случаев носила персистирующий характер и сохранилась к моменту выписки пациентов из стационара; 4) среди транзиторных нарушений проводимости сердца наибольшую продолжительность имела АВ-блокада 1 степени, медиана времени до разрешения которой составила 420 мин.
Как и в случае с хирургическим протезированием АК основным механизмом развития нарушений проводимости сердца после ТИАК является механическая травма элементов проводящей системы сердца, располагающихся вблизи корня аорты. Длительное время считалось, что основным источником механической травмы проводящих путей сердца является каркас биопротеза, обладающий наибольшей радиальной силой по отношению к окружающим анатомическим структурам. Однако на сегодняшний день продемонстрирована отрицательная прогностическая роль как пре-, так и постдилатации в отношении вновь возникших нарушений проводимости сердца [15][16]. Две работы (Campelo-Parada F, et al. и Nuis RJ, et al.), в которых проводилась интраоперационная оценка ритма сердца, подтвердили данный тезис и показали, что ~50% нарушений проводимости при ТИАК возникали до этапа имплантации биопротеза [17][18]. В серии клинических наблюдений с использованием системы CoreValve, дополненной электрофизиологическим исследованием, Rubín JM, et al. также показали, что у 43% больных нарушения проводимости сердца развились на этапе баллонной вальвулопластики [19]. Полученные нами данные частично соотносятся с результатами зарубежных коллег: около трети всех нарушений проводимости сердца возникли до этапа раскрытия биопротеза, и еще около трети — на этапе баллонной постдилатации. Несмотря на наблюдаемую взаимосвязь между определенными этапами ТИАК и нарушениями АВ-проводимости, развитие последних, вероятно, является результатом комплексного воздействия каждого из процедурных этапов. Подобный механизм повреждения проводящих путей был описан упомянутым ранее Campelo-Parada F, et al. как "2 hit"-модель (модель "2 ударов"), при которой первый "удар" по проводящей системе осуществляется посредством инфляции баллонного катетера (инициация замедленного проведения импульса), за которым следует второй "удар" в виде постоянной компрессии проводящих путей каркасом эндопротеза [17]. Данную закономерность также подтверждает более низкая частота имплантации постоянного ЭКС (1,5%) и впервые возникшей БЛНПГ (3,3%) после изолированной баллонной вальвулопластики АК, выполненной по поводу дегенеративного аортального стеноза [20]. Таким образом, у отдельной категории больных, имеющих высокий риск послеоперационных нарушений проводимости, может быть оправданна методика прямой имплантации ТИАК [21][22]. На наш взгляд, применение данного подхода наиболее безопасно при умеренном кальцинозе створок АК, а также при использовании баллонорасширямых биопротезов, имплантация которых сопровождается одновременной дилатацией кальцинированных створок АК.
Большое значение для выбора стратегии послеоперационного ведения больных после ТИАК имеет информация, касающаяся частоты и потенциальных сроков разрешения транзиторных нарушений проводимости сердца. Полученные нами данные свидетельствуют о том, что транзиторный вариант течения наиболее характерен для полной АВ-блокады, разрешение которой в послеоперационном периоде было отмечено в 62,5% случаев. С другой стороны, АВ-блокада 1 степени и БЛНПГ имели тенденцию к более длительной персистенции и сохранялись перед выпиской из стационара в 71,4% и 65% случаев, соответственно. Частота развития нарушений проводимости сердца в раннем послеоперационном периоде (с момента окончания процедуры ТИАК до выписки из стационара) в настоящем исследовании относительно невелика (9,9%) и представлена в основном изолированным удлинением интервала PQ. Несмотря на это, мы наблюдали один случай госпитальной летальности вследствие отсроченной полной АВ-блокады через 48 ч после процедуры ТИАК у пациентки с исходной БПНПГ. Интраоперационно данный случай осложнился дислокацией протеза и повторным транскатетерным репротезированием. Это клиническое наблюдение подчеркивает важность динамического мониторинга пациентов, перенесших ТИАК, посредством непрерывного ЭКГ-мониторинга, аналогичного хирургической практике. В настоящий момент в нашей клинической практике мы осуществляем продленный послеоперационный ЭКГ-мониторинг (24-48 ч) у пациентов, имеющих предикторы нарушения проводимости сердца, а также у лиц с впервые возникшей БЛНПГ и/или транзиторной полной АВ-блокадой. Электрод для временной электрокардиостимуляции при этом удаляется как минимум через 48 ч после процедуры после анализа результатов ХМ сердечного ритма.
На наш взгляд, практическое значение интраоперационной оценки сердечного ритма при ТИАК существенно недооценено. Детальный интраоперационный анализ ритма сердца может не только предоставить важную информацию о взаимосвязи различных хирургических факторов с нарушениями проводимости, но и помочь в прогнозировании подобных нарушений в послеоперационном периоде. Одной из немногочисленных работ, в которой проводился интраоперационный анализ ритма сердца при ТИАК, является работа Nuis RJ, et al. [18]. В данной работе интраоперационную оценку ритма сердца проводили на основании записи 12-канальной ЭКГ, которую в режиме реального времени оценивали два независимых специалиста по интервенционной кардиологии. Подтверждался факт развития различных нарушений проводимости сердца на одном из 6 этапов процедуры (катетеризация и позиционирование жесткого проводника в ЛЖ; позиционирование баллонного катетера для вальвулопластики; непосредственная дилатация баллонного катетера; позиционирование системы доставки в выходном отделе ЛЖ; имплантация биопротеза; извлечение всех инструментов из корня аорты и ЛЖ). По мнению авторов, основными ограничениями данного диагностического подхода является возможность пропуска некоторых электрокардиографических изменений вследствие человеческого фактора, а также отсутствие возможности в постоянном мониторинге сердечного ритма в раннем послеоперационном периоде. На наш взгляд, интраоперационный ХМ сердечного ритма лишен подобных ограничений: запись ЭКГ непрерывна; процесс выявления нарушений АВ-проводимости в большинстве случаев автоматизирован; имеется возможность точного сопоставления временных промежутков между различными хирургическими этапами и выявленными нарушениями ритма; продленный мониторинг (24-74 ч) делает возможным выявление преходящих нарушений проводимости в раннем послеоперационном периоде.
Ограничения исследования. Представленная работа имеет ряд ограничений. Учитывая наблюдательный характер исследования, а также отсутствие регрессионного анализа, мы не можем достоверно судить о влиянии тех или иных хирургических этапов на развитие процедурных нарушений АВ-проводимости. Регистрация ЭКГ путем ХМ осуществлялась в течение всей процедуры, а также в последующие 24 ч после нее. Следовательно, потенциальные преходящие нарушения проводимости, возникшие в более поздние сроки, могли быть не зарегистрированы. Точная оценка продолжительности транзиторной формы полной АВ-блокады была невозможна вследствие работы временного ЭКС. Поскольку в исследование были включены лица с исходным высоким риском нарушений АВ-проводимости, экстраполяция полученных результатов на всю категорию больных, направляемых на ТИАК, может быть ограничена.
Заключение
Около трети нарушений проводимости сердца при ТИАК возникают до фактической имплантации биопротеза. Наиболее частым нарушением проводимости сердца после ТИАК является впервые возникшая полная БЛНПГ, которая в большинстве случаев носит персистирующий характер и сохраняется к моменту выписки пациента из стационара. Интраоперационное ХМ сердечного ритма при ТИАК может являться важным инструментом для оценки и прогнозирования различных нарушений проводимости сердца, а также определения оптимальной послеоперационной стратегии ведения пациентов.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Список литературы
1. Otto CM, Nishimura RA, Bonow RO, et al. 2020 ACC/AHA guideline for the management of patients with valvular heart disease: executive summary: a report of the American College of Cardiology/American Heart Association Joint Committee on Clinical Practice Guidelines. Circulation. 2021;143(5):e35-e71. doi:10.1161/CIR.0000000000000932.
2. Алекян Б.Г., Ручкин Д.В., Карапетян Н.Г. и др. Клинический случай гибридного лечения пациента с критическим стенозом аортального клапана, поражением ствола левой коронарной артерии и кровоточащим раком желудка. Патология кровообращения и кардиохирургия. 2022;26(2):58-65. doi:10.21688/1681-3472-2022-2-58-65.
3. Fujita B, Schmidt T, Bleiziffer S, et al. Impact of new pacemaker implantation following surgical and transcatheter aortic valve replacement on 1-year outcome. Eur J Cardiothorac Surg. 2020;57(1):151-9. doi:10.1093/ejcts/ezz168.
4. Алекян Б.Г., Титов Н.С. Рентгенэндоваскулярное лечение клапанного стеноза аорты в сочетании с ишемической болезнью сердца: систематический обзор. Патология кровообращения и кардиохирургия. 2024;28(2):7-20. doi:10.21688/1681-3472-2024-2-7-20.
5. Alperi Garcia A, Muntané-Carol G, Junquera L, et al. Can we reduce conduction disturbances following transcatheter aortic valve replacement? Expert Rev Med Devices. 2020;17(4):309-22. doi:10.1080/17434440.2020.1741349.
6. Nuche J, Ellenbogen KA, Mittal S, et al. Conduction Disturbances After Transcatheter Aortic Valve Replacement: An Update on Epidemiology, Preventive Strategies, and Management. JACC Cardiovasc Interv. 2024;17(22):2575-95. doi:10.1016/j.jcin.2024.07.032.
7. Zaid S, Sengupta A, Okoli K, et al. Novel Anatomic Predictors of New Persistent Left Bundle Branch Block After Evolut Transcatheter Aortic Valve Implantation. American Journal of Cardiology. 2020;125(8):1222-9. doi:10.1016/j.amjcard.2020.01.008.
8. Wendler O, Schymik G, Treede H, et al. SOURCE 3: 1-year outcomes post-transcatheter aortic valve implantation using the latest generation of the balloon-expandable transcatheter heart valve. European Heart Journal. 2017;38(36):2717-26. doi:10.1093/eurheartj/ehx294.
9. Faroux L, Chen S, Muntané-Carol G, et al. Clinical impact of conduction disturbances in transcatheter aortic valve replacement recipients: a systematic review and meta-analysis. Eur Heart J. 2020;41(29):2771-81. doi:10.1093/eurheartj/ehz924.
10. Sasaki K, Kuwata S, Izumo M, et al. Three-Year Clinical Impacts of Permanence, Resolution, and Absence of Newly-Developed Left Bundle Branch Block After Transcatheter Aortic Valve Replacement. Am J Cardiol. 2023;202:166-8. doi:10.1016/j.amjcard. 2023.06.092.
11. Piazza N, de Jaegere P, Schultz C, et al. Anatomy of the aortic valvar complex and its implications for transcatheter implantation of the aortic valve. Circ Cardiovasc Interv. 2008;1(1):74-81. doi:10.1161/CIRCINTERVENTIONS.108.780858.
12. Cabrera JÁ, Anderson RH, Porta-Sánchez A, et al. The Atrioventricular Conduction Axis and its Implications for Permanent Pacing. Arrhythm Electrophysiol Rev. 2021;10(3): 181-9. doi:10.15420/aer.2021.32.
13. Vahanian A, Beyersdorf F, Praz F, et al. ESC/EACTS Scientific Document Group. 2021 ESC/EACTS Guidelines for the management of valvular heart disease. Eur Heart J. 2021;43(7):561-632. doi:10.1093/eurheartj/ehab395.
14. Surawicz B, Childers R, Deal BJ, et al. AHA/ACCF/HRS recommendations for the standardization and interpretation of the electrocardiogram: part III: intraventricular conduction disturbances: a scientific statement from the American Heart Association Electrocardiography and Arrhythmias Committee, Council on Clinical Cardiology; the American College of Cardiology Foundation; and the Heart Rhythm Society. Endorsed by the International Society for Computerized Electrocardiology. J Am Coll Cardiol. 2009;53:976-81. doi:10.1016/j.jacc.2008.12.013.
15. Mahajan S, Gupta R, Malik AH, et al. Predictors of permanent pacemaker insertion after TAVR: a systematic review and updated meta-analysis. J Cardiovasc Electrophysiol. 2021;32(5):1411-20. doi:10.1111/jce.14986.
16. Ravaux JM, Van Kuijk SMJ, Di Mauro M, et al. Incidence and predictors of permanent pacemaker implantation after transcatheter aortic valve procedures: data of the Netherlands Heart Registration (NHR). J Clin Med. 2022;11(3):560. doi:10.3390/jcm11030560.
17. Campelo-Parada F, Nombela-Franco L, Urena M, et al. Timing of Onset and Outcome of New Conduction Abnormalities Following Transcatheter Aortic Valve Implantation: Role of Balloon Aortic Valvuloplasty. Rev Esp Cardiol (Engl Ed). 2018;71(3):162-9. English, Spanish. doi:10.1016/j.rec.2017.04.010.
18. Nuis RJ, Van Mieghem NM, Schultz CJ, et al. Timing and potential mechanisms of new conduction abnormalities during the implantation of the Medtronic CoreValve System in patients with aortic stenosis. Eur Heart J. 2011;32(16):2067-74. doi:10.1093/eurheartj/ehr110.
19. Rubín JM, Avanzas P, del Valle R, et al. Atrioventricular conduction disturbance characterization in transcatheter aortic valve implantation with the CoreValve prosthesis. Circ Cardiovasc Interv. 2011;4(3):280-6. doi:10.1161/CIRCINTERVENTIONS.111.961649.
20. Laynez A, Ben-Dor I, Hauville C, et al. Frequency of cardiac conduction disturbances after balloon aortic valvuloplasty. Am J Cardiol. 2011;108(9):1311-5. doi:10.1016/j.amjcard.2011.06.049.
21. Bernardi FL, Ribeiro HB, Carvalho LA, et al. Direct Transcatheter Heart Valve Implantation Versus Implantation With Balloon Predilatation: Insights From the Brazilian Transcatheter Aortic Valve Replacement Registry. Circ Cardiovasc Interv. 2016;9(8):e003605. doi:10.1161/CIRCINTERVENTIONS.116.003605.
22. Benetos G, Karmpalioti M, Drakopoulou M, et al. One-year clinical and echocardiographic outcomes of direct implantation of a self-expanding valve. Catheter Cardiovasc Interv. 2021;98(3):E403-E411. doi:10.1002/ccd.29389
Об авторах
А. А. БарановРоссия
Баранов Алексей Алексеевич — врач по рентгенэндоваскулярным диагностике и лечению, н.с.
Новосибирск
О. А. Быстрицкая
Россия
Быстрицкая Ольга Анатольевна — врач по функциональной диагностике
Новосибирск
Е. С. Замараева
Россия
Замараева Елена Степановна — врач по функциональной диагностике
Новосибирск
А. Г. Бадоян
Россия
Бадоян Арам Гозоевич — к.м.н., врач по рентгенэндоваскулярным диагностике и лечению, н.с.
Новосибирск
Д. А. Хелимский
Россия
Хелимский Дмитрий Александрович — к.м.н., врач по рентгенэндоваскулярным диагностике и лечению, н.с.
Новосибирск
А. Ю. Цыденова
Россия
Цыденова Арюна Юрьевна — врач по рентгенэндоваскулярным диагностике и лечению, н.с.; ассистент кафедры сердечно-сосудистой хирургии
Новосибирск
И. С. Перегудов
Россия
Перегудов Иван Сергеевич — врач-сердечно-сосудистый хирург
Новосибирск
А. Г. Филиппенко
Россия
Филиппенко Алексей Германович — к. м. н., врачсердечно-сосудистый хирург
Новосибирск
М. А. Юсупова
Россия
Юсупова Марьям Абдулвахидовна — врач по рентгенэндоваскулярным диагностике и лечению
Краснодар
С. В. Майнгарт
Россия
Майнгарт Сергей Владимирович — врач по рентгенэндоваскулярным диагностике и лечению
Краснодар
А. Н. Федорченко
Россия
Федорченко Алексей Николаевич — д. м. н., зав. отделением рентгенхирургических методов диагностики и лечения
Краснодар
О. В. Крестьянинов
Россия
Крестьянинов Олег Викторович — д. м. н., руководитель научно-исследовательского отдела эндоваскулярной хирургии, врач по рентгенэндоваскулярным диагностике и лечению; профессор кафедры сердечно-сосудистой хирургии
Новосибирск
Дополнительные файлы
- Около трети нарушений проводимости сердца при транскатетерной имплантации аортального клапана (ТИАК) возникают до фактической имплантации биопротеза.
- Наиболее частым нарушением проводимости сердца после ТИАК является впервые возникшая полная блокада левой ножки пучка Гиса, которая в большинстве случаев носит персистирующий характер и сохраняется к моменту выписки пациента из стационара.
- Интраоперационное холтеровское мониторирование сердечного ритма при ТИАК может являться важным инструментом для оценки и прогнозирования различных нарушений проводимости сердца, а также определения оптимальной послеоперационной стратегии ведения пациентов.
Рецензия
Для цитирования:
Баранов А.А., Быстрицкая О.А., Замараева Е.С., Бадоян А.Г., Хелимский Д.А., Цыденова А.Ю., Перегудов И.С., Филиппенко А.Г., Юсупова М.А., Майнгарт С.В., Федорченко А.Н., Крестьянинов О.В. Время и механизмы развития нарушений проводимости сердца при транскатетерной имплантации аортального клапана: данные интраоперационного холтеровского мониторирования сердечного ритма. Российский кардиологический журнал. 2025;30(4):6300. https://doi.org/10.15829/1560-4071-2025-6300. EDN: WJFZIA
For citation:
Baranov A.A., Bystritskaya O.A., Zamaraeva E.S., Badoyan A.G., Khelimsky D.A., Tsydenova A.Yu., Peregudov I.S., Filippenko A.G., Yusupova M.A., Maingart S.V., Fedorchenko A.N., Krestyaninov O.V. Timing and pathogenesis of heart conduction disorders during transcatheter aortic valve implantation: data of intraoperative Holter monitoring. Russian Journal of Cardiology. 2025;30(4):6300. (In Russ.) https://doi.org/10.15829/1560-4071-2025-6300. EDN: WJFZIA
JATS XML

















































