Перейти к:
Индекс летального риска — новый инструмент прогнозирования однолетней летальности больных хронической сердечной недостаточностью со сниженной фракцией выброса левого желудочка
https://doi.org/10.15829/1560-4071-2025-6222
EDN: ILTPGD
Аннотация
Цель. Разработать критерии прогнозирования однолетней летальности больных хронической сердечной недостаточностью со сниженной фракцией выброса левого желудочка (СНнФВ) после установки имплантируемого кардиовертера-дефибриллятора с целью первичной профилактики внезапной сердечной смерти.
Материал и методы. Полный протокол исследования прошел 451 больной СНнФВ, направленный для установки имплантируемого кардиовертера-дефибриллятора для первичной профилактики внезапной сердечной смерти. Участники исследования были подвергнуты предимплантационному скринингу клинических, инструментальных и лабораторных показателей, проспективному наблюдению в течение 12 мес. для регистрации однолетней смерти от осложнений сердечно-сосудистых заболеваний (ССЗ). Для решения поставленной задачи были сформированы обучающая и тестовая выборки.
Результаты. Однолетняя смерть от осложнений ССЗ в обучающей группе была зарегистрирована у 35 больных (11%). При однофакторном анализе было выделено 6 факторов с наибольшим прогностическим потенциалом (р<0,1), связанных с возникновением исследуемой конечной точки. К ним относились клинические данные (наличие в анамнезе артериальной гипертензии и/или ожирения); эхокардиографические параметры (фракция выброса левого желудочка <25%, наличие эксцентрической гипертрофии миокарда левого желудочка); лабораторные показатели (скорость клубочковой фильтрации <60 мл/ мин/1,73 м2, N-концевой промозговой натрийуретический пептид >2000 пг/ мл). Исходя из значений регрессионных коэффициентов каждому фактору присваивались баллы, сумма которых определяла значение нового предложенного индекса — индекса летального риска (ИЛР). Значения ИЛР >3 баллов позволяют прогнозировать однолетнюю вероятность развития смерти по причине осложнений ССЗ у больных хронической сердечной недостаточностью с чувствительностью 85,7% и специфичностью 76,8%. Применение ИЛР у больных тестовой выборки продемонстрировало очень хорошее качество модели в прогнозировании риска однолетней летальности по причине осложнений ССЗ (AUC 0,852±0,069 с 95% доверительным интервалом: 0,716-0,988; р=0,0001).
Заключение. На основании полученных результатов был разработан индекс летального риска, практическое применение которого направлено на совершенствование оказания медицинской помощи и на разработку риск-ориентированной стратегии ведения больных СНнФВ.
Ключевые слова
Для цитирования:
Илов Н.Н., Пальникова О.В., Стомпель Д.Р., Зорин Д.А., Романцов Е.И., Терентьева М.Г., Абдулкадыров А.М., Паскеев Д.Р., Куликова Е.А., Климчук Д.О., Петрова О.В., Нечепуренко А.А., Колесников В.Н., Бойцов С.А. Индекс летального риска — новый инструмент прогнозирования однолетней летальности больных хронической сердечной недостаточностью со сниженной фракцией выброса левого желудочка. Российский кардиологический журнал. 2025;30(6):6222. https://doi.org/10.15829/1560-4071-2025-6222. EDN: ILTPGD
For citation:
Ilov N.N., Palnikova O.V., Stompel D.R., Zorin D.A., Romantsov E.I., Terentyeva M.G., Abdulkadyrov A.M., Paskeev D.R., Kulikova E.A., Klimchuk D.O., Petrova O.V., Nechepurenko A.A., Kolesnikov V.N., Boytsov S.A. Lethal risk index — a novel tool for predicting one-year mortality in patients with heart failure with reduced ejection fraction. Russian Journal of Cardiology. 2025;30(6):6222. (In Russ.) https://doi.org/10.15829/1560-4071-2025-6222. EDN: ILTPGD
Прогнозирование нежелательных событий давно стало важным инструментом клинициста, позволяющим идентифицировать пациентов, нуждающихся в более интенсивном мониторинге или госпитализации, предоставляющим информацию, необходимую для определения приоритетности в оказании определенных видов медицинской помощи, а также выстраивании персонализированной терапевтической стратегии. Реализация риск-ориентированного подхода имеет особое значение при принятии решения о применении инвазивных методов лечения, что приобретает дополнительную актуальность при большом числе потенциальных кандидатов на оказание высокотехнологичной помощи в условиях ограниченных медицинских ресурсов.
В действующих национальных и европейских рекомендациях по профилактике внезапной сердечной смерти (ВСС) с самым высоким доказательным уровнем регламентируется отказ от применения имплантируемого кардиовертера-дефибриллятора (ИКД) в случае ожидаемой продолжительности жизни больного <1 года [1]. Такая позиция связана с определением конечной точки большинства крупных проспективных регистров, определяемой как смерть от всех причин. По факту, в случае отсутствия известной некардиальной причины, способной привести к летальному исходу (онкологические заболевания, травмы и пр.), под такой расплывчатой формулировкой скрывается смерть по причине острой декомпенсации сердечной недостаточности (ОДСН). Частота смерти по причине ОДСН составляет по данным разным авторов 11-16% [2], что подчеркивает востребованность исследований, направленных на расчет вероятности развития этого нежелательного события.
Терминальная стадия хронической сердечной недостаточности (ХСН) нередко сопровождается длительным состоянием электрической нестабильности миокарда, которое может стать причиной сердечно-сосудистой смерти. В таких случаях шоки, наносимые ИКД, часто оказываются неэффективными, приводя к значительным физическим и психологическим страданиям пациента, что заставляет задуматься о необходимости деактивации устройства [3]. В условиях высокого риска смерти от ОДСН эффективность применения дорогостоящего ИКД существенно снижается. Тем не менее общепризнанных и валидированных методов, позволяющих определять этот риск, не разработано, и решение об отказе в имплантации устройства остается на усмотрение врача.
Цель работы: разработать критерии прогнозирования однолетней летальности больных ХСН со сниженной фракцией выброса (ФВ) левого желудочка (ЛЖ) после установки ИКД с целью первичной профилактики ВСС.
Материал и методы
Изложенные в статье данные были получены в рамках завершенного одноцентрового проспективного исследования ИДЕАЛ. Подробный дизайн исследования представлен в публичном регистре clinicaltrials.gov (NCT05539898).
Критерии включения: больные ХСН II-III функционального класса (ФК) по классификации NYHA с ФВ ЛЖ ≤35% на фоне оптимальной медикаментозной терапии в течение последних 6 мес., отобранные для проведения имплантации ИКД с целью первичной профилактики ВСС. Обязательным условием включения в исследование было проведение максимально возможной реваскуляризации миокарда (при наличии показаний).
Критерии невключения: пациенты с гипертрофической кардиомиопатией, аритмогенной дисплазией правого желудочка, показаниями к кардиохирургическому вмешательству (реваскуляризации, коррекции клапанной недостаточности).
Дизайн исследования, в соответствии с Хельсинкской декларацией Всемирной медицинской ассоциации и правилами надлежащей клинической практики (GCP), отражен в протоколе, одобренном независимым этическим комитетом ФГБОУ ВО Астраханский ГМУ Минздрава России (рис. 1).
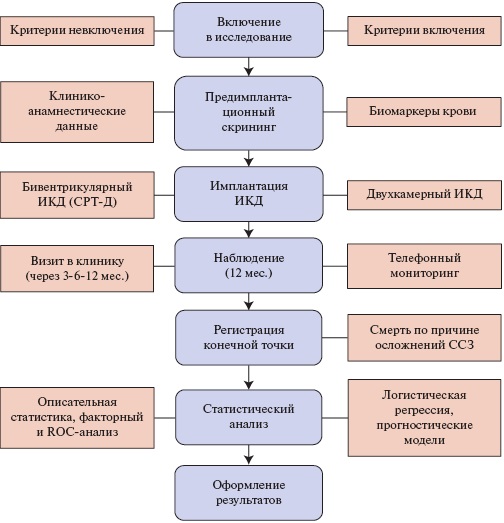
Рис. 1. Поточная диаграмма процесса (flow chart), отражающая дизайн исследования.
Сокращения: ИКД — имплантируемый кардиовертер-дефибриллятор, СРТ-Д — имплантируемый кардиовертер-дефибриллятор с функцией сердечной ресинхронизирующей терапии, ССЗ — сердечно-сосудистые заболевания.
После проверки на соответствие критериям включения/невключения проводилось стандартное общеклиническое обследование, входящее в алгоритм диагностики больных ХСН [4]. Дополнительно проводилась speckle-tracking эхокардиография, выполнялось определение концентраций биомаркеров крови (электролиты крови, С-реактивный белок, креатинин, растворимого супрессора туморогенеза-2, N-концевой промозговой натрийуретический пептид (NT-proBNP), галектин-3). На основании концентрации креатинина крови проводился расчет скорости клубочковой фильтрации (СКФ) по формуле CKD-EPI (Chronic Kidney Disease Epidemiology Collaboration).
Далее в соответствии с действующими клиническими рекомендациями [4] проводилась имплантация двухкамерного ИКД либо ИКД с функцией сердечной ресинхронизирующей терапии (СРТ) (СРТ-Д), после чего в течение 12 мес. участники исследования проспективно наблюдались кардиологами по месту жительства и кардиологами имплантирующего центра для контроля получаемой медикаментозной терапии и регистрации конечной точки — однолетней смерти от осложнений сердечно-сосудистых заболеваний (ССЗ), основной причиной которой было развитие ОДСН. В последующем, была выполнена статистическая обработка полученных данных, включающая следующие этапы: описательная статистика, проверка количественных данных на соответствие закону нормального распределения (с помощью критерия Колмогорова-Смирнова), сравнительный анализ количественных данных (с помощью t-критерия Стьюдента для независимых выборок при нормальном распределением либо с помощью непараметрического U-критерия Манна-Уитни, если распределение данных не соответствует закону нормального распределения); сравнение качественных переменных с помощью χ² Пирсона, бинарная логистическая регрессия с пошаговым включением/исключением, оценка качества полученных моделей с помощью ROC-анализа и оценки площади под кривой. Для построения графиков и диаграмм, демонстрирующих результаты, использовались соответствующие функции программ IBM SPSS Statistics 26 и Jamovi 2.3.28. В таблицах данные представлены в виде абсолютного числа больных (%) или в виде Me (Q1-Q3), если не указано иное.
Расчет выборки для выявления статистически значимых результатов анализа с помощью логистической регрессии проводился в программе GPower 3.1.9.4 на основе априорного типа расчета мощности z-теста. Входными параметрами являлись двусторонняя асимптотическая значимость, α=0,05, β=20%, соответственно, мощность исследования составит 80%, распределение биномиальное, модель сбалансированная π=0,5, поправка на взаимодействие независимых факторов между собой 0,1 (для R²). Для расчета выборки оценивалось влияние каждого предиктора на развитие исхода. Шансы возникновения исхода в исследуемой группе в 2,5 раз выше, чем в контрольной при воздействии предиктора "Наличие ишемической болезни сердца": отношение шансов (ОШ) 2,2; 95% доверительный интервал (ДИ): 1,2-5,1. При введении этих параметров объем выборки составил 214 человек. Для решения поставленных задач в исследование требуется включение не менее 450 пациентов, из которых было запланировано сформировать 2 выборки: обучающую и тестовую.
Результаты
Клинико-демографическая характеристика участников исследования
Итоговую выборку, прошедшую полный протокол исследования, составил 451 пациент с ХСН II-III ФК и ФВ ЛЖ 29 (25-33)%. В сформированной когорте преобладали мужчины (371 пациент, 82%) трудоспособного возраста (57 (51-62) лет).
Больные перед инициацией участия в наблюдательном регистре были подвергнуты максимально возможной реваскуляризации (184 больных, 41%), при наличии показаний была проведена коррекция клапанной патологии (87 больных, 19%). Все пациенты получали оптимальную медикаментозную терапию ХСН, соответствовавшую клиническим рекомендациям, действующим на момент включения в исследование. В ходе проспективного наблюдения медикаментозная терапия корректировалась исходя из клинического статуса пациента и с учетом возможности назначения квадротерапии в соответствии с рекомендациями по лечению ХСН пересмотра 2020г.
По окончании наблюдения были сформированы две выборки: обучающая, данные которой в дальнейшем использовались для поиска прогностических факторов и разработки многофакторных прогностических моделей, и тестовая, которая использовалась для проверки точности предсказания изучаемых конечных точек. Группы формировались на основе механизма случайного отбора в соотношении 70 и 30%, соответственно, и существенно не различались по основным клинико-демографическим параметрам и известным факторам риска смерти по причине ОДСН.
Частота возникновения первичной конечной точки
Однолетняя смерть от осложнений ССЗ была зарегистрирована у 35 больных (11%). Согласно полученным данным выживаемость к концу 12‑мес. наблюдения составила 89% (95% ДИ: 85,6-92,5%). Больше всех исследуемых летальных событий было зарегистрировано в начале наблюдения (0-3 мес., 10 смертей) и в завершающем периоде наблюдения (9-12 мес., 17 смертей).
Сформированные в зависимости от достижения конечной точки группы оказались сопоставимы по большинству клинико-демографических характеристик. Были выявлены статистически достоверные различия по наличию в анамнезе ожирения и артериальной гипертензии (АГ), а также по уровню систолического артериального давления (САД) (табл. 1).
Таблица 1
Клинико-демографическая характеристика пациентов обучающей выборки в зависимости от регистрации смерти по причине осложнений ССЗ
|
Клинический показатель |
Все больные (n=319) |
Выжившие больные (n=284) |
Умершие больные (n=35) |
P 3-4 |
|
Возраст, лет |
57 (51-63) |
58 (51-63) |
55 (50-59) |
0,074 |
|
Мужской пол, n (%) |
265 (83) |
237 (84) |
28 (80) |
0,607 |
|
ИМТ, кг/м² |
28,7 (25,4-32,5) |
28,7 (25,4-32,3) |
28,4 (25-29,7) |
0,166 |
|
ИБС, n (%) |
160 (50) |
143 (50) |
17 (49) |
0,842 |
|
ПИКС из числа больных ИБС, n (%) |
118 (37) |
105 (37) |
13 (37) |
0,996 |
|
НКМП, n (%) |
159 (50) |
141 (50) |
18 (51) |
0,913 |
|
ХСН 2 ФК, n (%) |
22 (7) |
18 (6) |
4 (11) |
0,268 |
|
ХСН 3 ФК, n (%) |
233 (74) |
205 (73) |
28 (80) |
0,356 |
|
АГ в анамнезе, n (%) |
180 (56) |
168 (59) |
12 (34) |
0,005 |
|
Сахарный диабет, n (%) |
61 (19) |
51 (18) |
10 (29) |
0,132 |
|
Ожирение в анамнезе |
119 (37) |
115 (41) |
4 (11) |
0,001 |
|
Ожирение на момент включения в исследование, n (%) |
133 (42) |
118 (42) |
15 (43) |
0,882 |
|
Мозговой инсульт, n (%) |
20 (6) |
16 (6) |
4 (11) |
0,182 |
|
ХБП, n (%) |
139 (46) |
125 (47) |
14 (40) |
0,447 |
|
Анемия в анамнезе, n (%) |
21 (8) |
19 (8) |
2 (6) |
0,681 |
|
ФП (пароксизмальная/персистирующая форма), n (%) |
90 (28) |
81 (29) |
9 (26) |
0,728 |
|
ФП (постоянная форма), n (%) |
26 (8) |
22 (8) |
4 (11) |
0,461 |
|
Неустойчивые пароксизмы ЖТ в анамнезе, n (%) |
43 (14) |
37 (13) |
6 (17) |
0,501 |
|
САД, мм рт.ст. |
120 (110-130) |
120 (110-130) |
110 (100-130) |
0,025 |
|
ДАД, мм рт.ст. |
80 (70-80) |
80 (70-80) |
70 (60-83) |
0,281 |
|
ЧСС, уд./мин |
78 (68-88) |
78 (68-88) |
80 (67-90) |
0,896 |
|
Хирургические вмешательства на сердце |
||||
|
Реваскуляризация (КШ либо ЧКВ), n (%) |
134 (43) |
120 (43) |
14 (40) |
0,747 |
|
Коррекция клапанной недостаточности, n (%) |
62 (20) |
54 (19) |
8 (23) |
0,616 |
|
Пластика ЛЖ, n (%) |
29 (9) |
24 (9) |
5 (14) |
0,270 |
|
Эхокардиографические показатели |
||||
|
иКДО ЛЖ, мл/м² |
114 (97-133) |
117 (96-142) |
127 (107-135) |
0,184 |
|
иКСО ЛЖ, мл/м² |
80 (68-97) |
81 (67-102) |
97 (73-117) |
0,045 |
|
иКДР ЛЖ, см/м² |
3,4 (3,0-3,9) |
3,4 (3,0-3,8) |
3,6 (3,4-4,0) |
0,003 |
|
иКСР ЛЖ, см/м² |
2,9 (2,5-3,3) |
2,9 (2,5-3,3) |
2,9 (2,6-3,5) |
0,662 |
|
ФВ ЛЖ Simpson, % |
29 (25-32) |
29 (25-33) |
27 (20-32) |
0,043 |
|
ПЖбаз, см |
4,0 (3,6-4,5) |
3,9 (3,2-4,2) |
4,5 (3,7-4,7) |
0,002 |
|
СДЛА, мм рт.ст. |
44 (40-56) |
42 (31-52) |
49 (37-64) |
0,012 |
|
Получаемая медикаментозная терапия |
||||
|
β-адреноблокаторы, n (%) |
319 (100) |
284 (100) |
35 (100) |
– |
|
иАПФ/АРА II, n (%) |
218 (68) |
192 (68) |
26 (74) |
0,423 |
|
АРНИ, n (%) |
111 (35) |
95 (34) |
16 (46) |
0,151 |
|
Антагонисты минералокортикоидов, n (%) |
283 (89) |
250 (88) |
33 (94) |
0,270 |
|
Петлевые диуретики, n (%) |
311 (98) |
277 (98) |
34 (97) |
0,889 |
|
иНГКТ-2, n (%) |
52 (16) |
43 (15) |
9 (26) |
0,110 |
|
Амиодарон, n (%) |
123 (39) |
110 (39) |
13 (37) |
0,498 |
|
Имплантированный ИКД |
||||
|
СРТ-Д, n (%) |
190 (60) |
170 (60) |
20 (57) |
0,757 |
|
Двухкамерный ИКД, n (%) |
129 (40) |
114 (40) |
15 (43) |
0,814 |
Примечание: данные представлены в виде абсолютного числа больных (%) или в виде Me (Q1-Q3).
Сокращения: АГ — артериальная гипертензия, АРА II — антагонисты к рецепторы ангиотензина II, АРНИ — ангиотензиновых рецепторов и неприлизина ингибиторы, ДАД — диастолическое артериальное давление, ЖТ — желудочковые тахиаритмии, иАПФ — ингибиторы ангиотензинпревращающего фермента, ИБС — ишемическая болезнь сердца, ИМТ — индекс массы тела, ИКД — имплантируемый кардиовертер-дефибриллятор, иНГКТ-2 — ингибиторы натрий-глюкозного котранспортера 2 типа, КА — коронарные артерии, иКДО — индексированный конечно-диастолический объем, иКДР — индексированный конечно-диастолический размер, иКСО — индексированный конечно-систолический объем, иКСР — индексированный конечно-систолический размер, КШ — коронарное шунтирование, ЛЖ — левый желудочек, ПЖбаз — размер правого желудочка в базальном отделе, НКМП — неишемическая кардиомиопатия, ПИКС — постинфарктный кардиосклероз, САД — систолическое артериальное давление, СДЛА — систолическое давление в лёгочной артерии, СКФ — скорость клубочковой фильтрации, СРТ-Д — имплантируемый кардиовертер-дефибриллятор с функцией сердечной ресинхронизирующей терапии, ФВ — фракция выброса, ФК — функциональный класс, ФП — фибрилляция предсердий, ХБП — хроническая болезнь почек, ХСН — хроническая сердечная недостаточность, ЧКВ — чрескожное коронарное вмешательство, ЧСС — частота сердечных сокращений, NT-proBNP — N-концевой промозговой натрийуретический пептид.
Анализ клинических факторов
При анализе клинических характеристик исследуемых пациентов было установлено наличие различий в величине САД: выжившие больные имели более высокие значения этого показателя: 120 (110-130) мм рт.ст. vs 110 (100-130) мм рт.ст. (р=0,025). Все больные, включенные в исследование, имели целевые значения артериального давления (АД) и получали медикаментозную терапию согласно национальным рекомендациям по лечению ХСН, в т.ч. препаратами, обладающими гипотензивным действием. По этой причине оценка наличия АГ на момент включения в исследование была затруднена. Шансы погибнуть вследствие осложнений ССЗ у больных, имеющих в анамнезе АГ, были в 2,8 раза ниже, чем у исследуемых пациентов, не имеющих АГ (ОШ 0,36; 95% ДИ: 0,17-0,75; р=0,005). Зависимость риска наступления первичной конечной точки от наличия АГ, оцененная с помощью логрангового критерия Мантеля-Кокса, была статистически достоверной (р=0,004) (рис. 2).
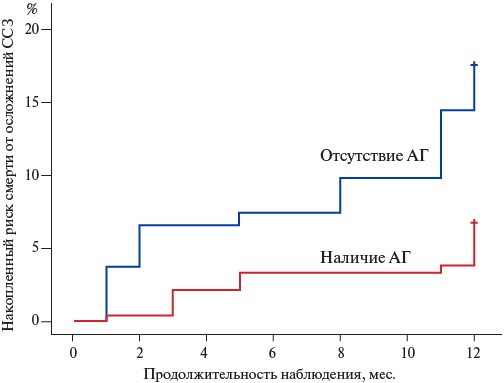
Рис. 2. Кривая Каплана-Мейера, отражающая взаимосвязь между наличием АГ и накопленным риском смерти от осложнений ССЗ у изучаемой когорты больных.
Сокращения: АГ — артериальная гипертензия, ССЗ — сердечно-сосудистые заболевания.
Наличие в анамнезе ожирения в 5,3 раза повышало вероятность выживания в течение года наблюдения (ОШ 0,19; 95% ДИ: 0,07-0,55; р=0,001). Среди исследованных больных пациентов с дефицитом массы тела (индекс массы тела (ИМТ) <18,5) выявлено не было.
Анализ электрокардиографических показателей
Большинство исследованных больных перед имплантацией ИКД имели синусовый ритм (81%). В целом для изучаемой когорты больных ХСН со сниженной ФВ ЛЖ (СНнФВ) было характерно отклонение электрической оси сердца влево (71%), наличие вольтажных признаков гипертрофии миокарда ЛЖ (62%); нарушение внутрипредсердной проводимости (продолжительность зубца Р — 120 (101-120) мс) и удлинение электрической систолы желудочков (QTcor — 465 (438-498) мс). Взаимосвязей между исследуемыми электрокардиографическим показателям и изучаемой конечной точкой выявлено не было.
Анализ эхокардиографических параметров
Согласно полученным данным для больных, умерших от осложнений ССЗ, было характерно ремоделирование ЛЖ по типу эксцентрической гипертрофии (94% vs 76%; р=0,021). В целом умершие по причине осложнений ССЗ имели большие размеры ЛЖ и правого желудочка, равно как и более высокое систолическое давление в легочной артерии (табл. 1).
В группе выживших ФВ ЛЖ превышала аналогичный параметр умерших больных: 29 (25-33)% vs 27 (20-32)%, р=0,043. Диагностическая значимость ФВ ЛЖ при прогнозировании вероятности однолетней летальности была оценена с помощью метода ROC-анализа. Было выбрано оптимальное разделяющее значение этого показателя. Величина ФВ ЛЖ <25% соответствовала прогнозу возникновения смерти от осложнений ССЗ в ближайший год с чувствительностью 46% и специфичностью 77%. Было выявлено, что при ФВ ЛЖ <25% риск однолетней летальности повышался почти в 3 раза (ОШ 2,78; 95% ДИ: 1,35-5,71; р=0,004).
Сравнительный анализ величины максимального систолического продольного стрейна указывал на худшие деформационные характеристики в базальных и средних сегментах ЛЖ (-6,0 (-8,9; -3,6) и -5,8 (-7,1; -3,5), соответственно). При этом статистически достоверных связей между деформационными показателями ЛЖ и возникновением смерти по причине осложнений ССЗ выявлено не было.
Анализ концентраций биомаркеров
Между исследуемыми группами были выявлены статистически достоверные различия по ряду лабораторных показателей. Так, умершие больные имели более высокие концентрации калия (4,5 (4,2-5,1) ммоль/л, в группе выживших — 4,4 (4,1-4,7) ммоль/л, р=0,049) и NT-proBNP (4559 (2456-6255) пг/мл, в группе выживших — 2307 (1253-4122) пг/мл, р=0,003) и меньшую величину СКФ (CKD EPI): 61 (54-69) мл/мин/1,73 м², в группе выживших — 68 (60-78) мл/мин/1,73 м².
Для определения критических значений выявленных количественных предикторов (p<0,05) проведен ROC-анализ. Было обнаружено, что при СКФ <60 мл/мин/1,73 м² риск смерти от осложнений ССЗ в течение года после имплантации ИКД повышался в 2,64 раза (ОШ 2,64; 95% ДИ: 1,28-5,46; р=0,007). В случае увеличения концентрации NT-proBNP >2000 пг/мл риск того же исхода возрастал в 3,32 раза (ОШ 3,32; 95% ДИ: 1,26-8,73; р=0,012). Прогностическое значение этих факторов доказано результатами многофакторного анализа (рис. 3).
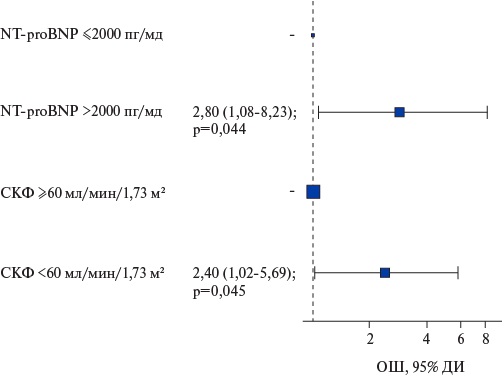
Рис. 3. График ОШ (многофакторный анализ) возникновения смерти от осложнений ССЗ в зависимости от регистрации отрезных значений биомаркеров.
Сокращения: ДИ — доверительный интервал, ОШ — отношение шансов, СКФ — скорость клубочковой фильтрации, NT-proBNP — N-концевой промозговой натрийуретический пептид.
Оценка влияния СРТ на риск смерти от осложнений ССЗ
Среди больных с имплантированным СРТ-Д, подвергнутых проспективному наблюдению, 59% ответили на СРТ увеличением ФВ ЛЖ ≥5% от исходного уровня, у 48% эффект СРТ проявился в виде снижения конечно-систолического объема ЛЖ ≥15% от доимплантационного значения. Между тем, проведенный статистический анализ не выявил достоверного влияния СРТ на однолетнюю смертность по причине развития осложнений ССЗ.
Многофакторный анализ предикторов смерти от осложнений ССЗ. Построение прогностических моделей
При однофакторном анализе было выделено 6 факторов с наибольшим прогностическим потенциалом (р<0,1), связанных с возникновением исследуемой конечной точки. К ним относились клинические данные: наличие в анамнезе АГ и/или ожирения; эхокардиографические параметры: ФВ ЛЖ <25%, наличие эксцентрической гипертрофии миокарда ЛЖ; лабораторные показатели: СКФ <60 мл/мин/1,73 м², NT-proBNP >2000 пг/мл. На основании данных показателей с использованием метода бинарной логистической регрессии была разработана прогностическая модель, позволяющая определять вероятность смерти, ассоциированной с осложнениями ССЗ у больных СНнФВ в течение ближайшего года (табл. 2).
Таблица 2
Предполагаемые предикторы возникновения смерти по причине осложнений ССЗ
|
Исследуемый показатель |
Однофакторный анализ |
Многофакторный анализ |
||||
|
ОШ |
95% ДИ |
P |
ОШ |
95% ДИ |
P |
|
|
Клинические предикторы |
||||||
|
Наличие в анамнезе АГ |
0,36 |
0,17-0,75 |
0,005 |
0,07 |
0,01-0,44 |
0,004 |
|
Наличие в анамнезе ожирения |
0,19 |
0,07-0,55 |
0,001 |
0,37 |
0,11-1,32 |
0,125 |
|
Эхокардиографические предикторы |
||||||
|
ФВ ЛЖ <25% |
2,78 |
1,35-5,71 |
0,004 |
1,83 |
0,70-4,81 |
0,217 |
|
Наличие эксцентрической ГМЛЖ |
4,79 |
1,11-20,62 |
0,021 |
3,24 |
0,65-16,10 |
0,150 |
|
Лабораторные предикторы |
||||||
|
СКФ <60 мл/мин/1,73 м² |
2,64 |
1,28-5,46 |
0,007 |
3,32 |
1,19-9,26 |
0,022 |
|
NT-proBNP >2000 пг/мл |
3,32 |
1,26-8,73 |
0,012 |
2,90 |
0,98-8,57 |
0,053 |
Сокращения: АГ — артериальная гипертензия, ГМЛЖ — гипертрофия миокарда левого желудочка, ДИ — доверительный интервал, ОШ — отношение шансов, СКФ — скорость клубочковой фильтрации, ФВ ЛЖ — фракция выброса левого желудочка, NT-proBNP — N-концевой промозговой натрийуретический пептид.
Полученная регрессионная модель является статистически значимой (р=0,0001). Исходя из значения коэффициента детерминации Найджелкерка, 29,6% дисперсии зависимой переменной (вероятности смерти по причине развития осложнений ССЗ) объясняется дисперсией изучаемых факторов.
Диагностическая эффективность при точке отсечения значений регрессионной функции 0,335 составила 72,6% (чувствительность — 74,3%, специфичность — 68,8%). Площадь под ROC-кривой, соответствующей взаимосвязи однолетнего прогноза смерти от осложнений ССЗ и значения регрессионной функции, составила 0,779, что согласно экспертной шкале для значений AUC соответствует хорошему качеству модели.
Исходя из значений регрессионных коэффициентов, большинство параметров имеют прямую связь, а показатели "наличие в анамнезе ожирения" и "наличие в анамнезе АГ" — обратную связь с вероятностью развития смерти по причине осложнений ССЗ. На основании рассчитанных β-коэффициентов каждому фактору присваивались баллы, сумма которых определяла значение нового предложенного индекса — индекса летального риска (ИЛР) (табл. 3). По результатам ROC-анализа значение индекса в 3 балла было принято в качестве порогового значения. Значения ИЛР >3 баллов позволяют прогнозировать однолетнюю вероятность развития смерти по причине осложнений ССЗ у больных ХСН с чувствительностью 85,7% и специфичностью 76,8%.
Таблица 3
Результаты бинарной логистической регрессии для прогнозирования смерти по причине осложнений ССЗ с преобразованием полученных β-коэффициентов в баллы
|
Предикторы |
β-коэффициент |
Баллы |
|
Наличие в анамнезе АГ |
-0,905 |
-1 |
|
Наличие в анамнезе ожирения |
-0,983 |
-2 |
|
ФВ ЛЖ <25% |
0,606 |
1 |
|
Наличие эксцентрической ГМЛЖ |
1,177 |
2 |
|
СКФ <60 мл/мин/1,73 м² |
1,201 |
2 |
|
NT-proBNP >2000 пг/мл |
1,066 |
2 |
Сокращения: АГ — артериальная гипертензия, ГМЛЖ — гипертрофия миокарда левого желудочка, ДИ — доверительный интервал, ОШ — отношение шансов, СКФ — скорость клубочковой фильтрации, ФВ ЛЖ — фракция выброса левого желудочка, NT-proBNP — N-концевой промозговой натрийуретический пептид.
Валидация результатов на пациентах тестовой выборки
Применение ИЛР на тестовой выборке продемонстрировало очень хорошее качество модели в прогнозировании риска однолетней летальности по причине осложнений ССЗ (AUC 0,852±0,069 с 95% ДИ: 0,716-0,988; р=0,0001). Повышение ИЛР на каждый 1 балл увеличивало риск летального исхода в 1,72 (95% ДИ: 1,30-2,27; р=0,001) раз.
В группе больных с высоким риском летального исхода (ИЛР >3 баллов, n=14) в ходе однолетнего наблюдения смерть по причине осложнений ССЗ была зарегистрирована в 43% (у 6 пациентов), в то время как при предполагаемом низком риске смерти (ИЛР ≤3 баллов, n=118) частота возникших летальных исходов составила 3% (у 3 больных) (рис. 4).
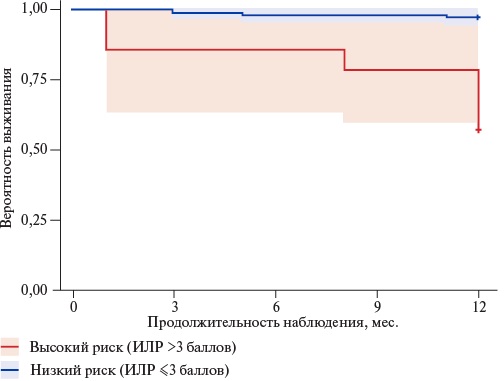
Рис. 4. Кривая Каплана-Мейера, отражающая взаимосвязь между значением ИЛР и вероятностью выживания исследованных больных.
Сокращение: ИЛР — индекс летального риска.
Обсуждение
Несомненная необходимость прогнозировать раннюю летальность перед принятием решения об имплантации ИКД, с одной стороны, и отсутствие сформулированных критериев для расчета вероятности такого исхода, с другой стороны, подчеркивают несовершенство действующих клинических рекомендаций по профилактике ВСС. По этой причине многими авторами разрабатываются прогностические системы, ставящие целью решение этой задачи, большинство из которых включает клинические или лабораторные предикторы. Так, Barsheshet А, et al. предложили набор из клинических, лабораторных и электрокардиографических показателей для предсказания общей смертности у больных с ИКД без функции СРТ [5]. В 2006г была представлена Seattle Heart Failure Model — прогностическая модель, разработанная для оценки ожидаемой продолжительности жизни и риска смерти у пациентов с ХСН [6]. Основанная не только на оценке клинических данных, но и информации о принимаемой медикаментозной терапии и имплантированных устройствах, шкала получила ограниченное применение вследствие недооценки клинического статуса (коморбидности) и отсутствия учета важных биомаркеров. В 2020г группой авторов из США был разработан калькулятор MADIT-ICD Benefit Score, основанный на клинических данных и информации о конечных точках четырех исследований MADIT, с участием >4500 больных ХСН [7]. В качестве предикторов неаритмической смерти были предложены: возраст ≥75 лет, ИМТ <23 кг/м², ФВ ЛЖ ≤25%, ФК ХСН ≥2, использование СРТ, наличие в анамнезе сахарного диабета и предсердных аритмий. Несмотря на многообещающие ожидания, было показано, что использование шкалы MADIT-ICD Benefit Score в повседневной клинической практике хоть и предоставляет дополнительную информацию о риске неаритмической смерти, но в целом не имеет преимуществ перед традиционным подходом к отбору больных с ХСН на ИКД, исходя из величины ФВ ЛЖ [8].
По мнению многих авторов, известные прогностические системы часто разрабатываются на основании данных исследований проведенных до появления новых классов медикаментозных препаратов для лечения ХСН, что может ограничивать эффективность их применения в реальной практике. Таким образом, стоит признать, что несмотря на большой массив накопленных наблюдательных данных, так и не была разработана эффективная прогностическая система, позволяющая прогнозировать риск смерти от осложнений ССЗ с развитием терминального состояния, рефрактерного к проводимой электротерапии ИКД.
В условиях реальной мировой практики каждый шестой больной СНнФВ декомпенсируется в течение ближайших 18 мес., переходя в категорию пациентов с высоким риском смерти от осложнений ССЗ [9]. Согласно полученным данным, частота наступления смерти больных СНнФВ по причине развития осложнений ССЗ в течение года после имплантации ИКД составила ~10%, несмотря на получение оптимальной медикаментозной терапии, интервенционного лечения ХСН (СРТ при наличии показаний) и регулярного наблюдения у кардиолога. В ранее проведенных крупных международных многоцентровых исследованиях с участием схожей когорты больных общая смертность в течение года после имплантации ИКД имела разные значения: 6% в Sudden Cardiac Death in Heart Failure Trial (SCD-Heft) [10], 9% в Multicenter Automatic Defibrillator Implantation Trial (MADIT-2) [11], 16% в Synergistic Effects of Risk Factors for Sudden Cardiac Death Study (SERF) [12]. Нам не удалось найти в свободном доступе похожих по дизайну отечественных исследований, в связи с чем представленные данные могут представлять интерес для оценки ранней летальности после имплантации ИКД у российских пациентов с СНнФВ.
Особенностью представленного исследования является выбранная конечная точка — однолетняя летальность от осложнений ССЗ, основным из которых чаще всего является ОДСН [13]. Авторская позиция заключается в гипотезе, согласно которой ассоциированные с сердечно-сосудистой системой факторы обладают максимальной прогностической способностью только применительно к выбранной конечной точке, и могут оказаться малочувствительными к смертности от всех причин.
В данном исследовании было показано, что анамнестические данные по АГ ассоциируется с трехкратным снижением риска однолетней смертности по причине развития осложнений ССЗ (ОШ 0,36; 95% ДИ: 0,17-0,754; р=0,005), а больные, умершие в течение периода наблюдения, имели более низкие значения САД: 110 (100-130) мм рт.ст. vs 120 (110-130) мм рт.ст., р=0,025. Известно, что АГ является признанным фактором риска, линейно связанным с нежелательными сердечно-сосудистыми событиями; известно, что первичная профилактика возникновения и ухудшения течения ХСН заключается в снижении уровня АД до целевых показателей [14]. С другой стороны, высказывается мнение, согласно которому низкое САД может указывать на прогрессирование сократительной дисфункции ЛЖ и выступать в качестве предиктора ОДСН [15]. При этом, вероятно, важно разделять низкое АД, связанное с тяжестью пациента, и снижение АД на фоне проводимой терапии. Имеет значение и тот факт, что низкое САД является фактором, существенно ограничивающим назначение и применение всех основных классов препаратов для лечения СНнФВ.
Неоднозначность клинической интерпретации величины САД у разных категорий больных ХСН была ярко проиллюстрирована в работе Ather S, et al. [16]. Сравнив летальность в группах больных с умеренной (3263 пациента) и выраженной систолической дисфункцией (2906 больных), авторы обнаружили, при 30%≤ ФВ ЛЖ <50% зависимость между САД и сердечно-сосудистой смертностью имеет U-образную форму с минимальной летальностью при САД 130-140 мм рт.ст. Интересной находкой стала выявленная линейная зависимость САД и сердечно-сосудистой смертности в группе ФВ ЛЖ <30%: при САД >140 мм рт.ст. вероятность летального исхода была минимальной, а при САД <120 мм рт.ст. — возрастала [16]. В крупном российском эпидемиологическом исследовании ЭПОХА-Д-ХСН была продемонстрирована аналогичная закономерность в отношении госпитального прогноза для больных ОДСН: при снижении уровня САД <120 мм рт.ст. увеличивались риски госпитальной летальности, в то время как увеличение САД на каждые 10 мм рт.ст. ассоциировалось со снижением риска летального исхода на 13-16% [17].
Тесная связь между уровнем САД и сердечно-сосудистой заболеваемостью и смертностью, вероятно, объясняется физиологией сердца. САД определяется величиной сердечного выброса и системным сосудистым сопротивлением. При сохраненной сократимости ЛЖ ведущим фактором, определяющим повышение САД, является периферическая вазоконстрикция. У больных СНнФВ низкое САД свидетельствует о снижении сердечного выброса, по этой причине повышенное САД ассоциируется со снижением смертности по причине осложнений ССЗ [18].
Достаточно неожиданным результатом стало выявленное влияние наличия ожирения в анамнезе на ожидаемую продолжительность жизни больного ХСН >1 года. Этот клинический предиктор повышал вероятность выживания в течение года наблюдения в 5,3 раза (ОШ 0,19; 95% ДИ: 0,07-0,55; р=0,001).
Выявленные в ходе данного исследования взаимоотношения между наличием в анамнезе ожирения и вероятностью смерти вследствие ОДСН могут укладываться в рамки описанного в литературе "парадокса ожирения". В метаанализе клинических исследований, включившем 28209 больных ХСН, Oreopoulos А, et al. показали, что в сравнении с пациентами с нормальным ИМТ больные ХСН с избыточной массой тела или ожирением имели более низкие показатели сердечно-сосудистой и общей смертности при наблюдении в течение в среднем 2,7 года [19]. Такие кардиопротективные эффекты связывают с эндокринной активностью жировой ткани, проявляющейся угнетением системного воспаления и замедлением атеросклероза, изменением концентрации адипонектина и других биологически активных агентов [20]. Противоположное по эффекту влияние ранее валидированных факторов риска на клинические конечные точки часто рассматривают как проявление обратной эпидемиологии. Результаты данного исследования следует рассматривать как с этой позиции, так и принимать во внимание потенциальное наличие спутывающих факторов (confounders), формирующих ложные зависимости.
В проведенном оригинальном исследовании было показано, что биомаркеры крови способны предоставлять информацию, помогающую выявить среди больных СНнФВ пациентов с крайне высоким риском смерти по причине осложнений ССЗ, что следует учитывать при отборе на имплантацию ИКД и, возможно, при определении приоритета в листе ожидания на операцию.
На большой когорте больных СНнФВ (8399 пациентов с ФК ХСН II-IV) было показано, что увеличение уровня NT-proBNP повышало вероятность декомпенсации ХСН и смерти вследствие развития ОДСН. Примечательно, что высокие концентрации этого биомаркера находились в обратной зависимости от уровня СКФ. Авторы не ставили целью выявить отрезное значение биомаркера, при этом медиана NT-proBNP у больных, подвергнутых наблюдению, составила 2067 пг/мл. В одном из наблюдательных исследований было отмечено, что каждое снижение СКФ на 15 мл/мин/1,73 м² было связано с повышением порога NT-proBNP на 43% для 99-го процентиля (95% ДИ: 1,21-1,69) [21]. Таким образом, повышение уровня NT-proBNP у больных СНнФВ отражает не только уровень миокардиального стресса, но и может указывать на прогрессирующую почечную дисфункцию, которая, согласно представленным результатам и данным других исследователей, имеет сильные ассоциации со смертностью по причине развития осложнений ССЗ.
Связь повышенного уровня NT-proBNP со сниженной функциональной активностью почек и прогрессированием ХСН часто объясняется единством патогенетических механизмов, реализующихся при этих состояниях [22]. В настоящее время не вызывает сомнений, что нарушение функции почек активирует ренин-ангиотензин-альдостероновую систему. Результатом становится задержка натрия и жидкости, вазоконстрикция, что приводит к увеличению преднагрузки на сердце. Повышенное растяжение стенок ЛЖ инициирует высвобождение биомаркеров миокардиального стресса — натрийуретических пептидов. В то же время почки являются единственным путем выведения NT-proBNP, поэтому у пациентов с хронической болезнью почек и снижением СКФ клиренс NT-proBNP снижается, а его уровень в крови еще больше повышается. Оба биомаркера часто включаются в список предикторов изучаемой конечной точки. Так, составленная согласно результатам исследования PARADIGM-HF (Prospective Comparison of ARNI With ACEI to Determine Impact on Global Mortality and Morbidity in Heart Failure) прогностическая система включала логарифм концентрации NT-proBNP (ОШ 1,61; 95% ДИ: 1,41-1,84; p<0,001), в то время как фактор "уровень СКФ до 60 мл/мин/1,73 м²" продемонстрировал свою предиктивную способность только при однофакторном анализе (ОШ 0,96; p<0,001) [15].
Вышеперечисленные факты подтверждают полученные результаты, согласно которым повышенный уровень NT-proBNP (>2000 пг/мл) указывал на высокий риск смети от осложнений ССЗ, особенно у больных с СКФ <60 мл/мин/1,73 м², что полностью согласуется с данными других исследователей [23]. Более того, снижение концентрации NT-proBNP может свидетельствовать об уменьшении риска смерти и вероятности развития ОДСН [24].
Проведенный статистический анализ не выявил достоверного влияния СРТ на однолетнюю смертность по причине развития осложнений ССЗ, что может быть связано с включением в исследование больных, у которых развилась терминальная ХСН, рефрактерная к СРТ. Неоднозначность отношения к СРТ как модификатору однолетней смертности от осложнений ССЗ объясняется и разными подходами к ведению больных с имплантированными устройствами, связанными с особенностями программирования СРТ, разной оценкой эффекта от этой терапии, отсутствием унифицированного подхода к предимплантационному отбору больных. В большинстве крупных рандомизированных исследований, показавших противоположный результат, сравнивалась общая смертность либо же смерть от всех причин была одной из составляющих композитной конечной точки, этот показатель отслеживался на протяжении длительного времени наблюдения (>2 лет). Существенным фактором, который стоит принимать во внимание при интерпретации полученных результатов, является тот факт, что все больные из нашего исследования были подвергнуты имплантации ИКД, что само по себе может позитивно модифицировать однолетнюю смертность [25].
Главным результатов проведенной работы стала разработка нового прогностического инструмента — ИЛР, основанного на применении рутинных клинико-анамнестических факторов, включенных в стандарты оказания помощи больным с ХСН. Валидация на тестовой выборке продемонстрировала хороший прогностический потенциал разработанной шкалы, полученные показатели диагностической эффективности оказались сопоставимыми с имеющимися ранее представленными аналогами либо даже превышали их.
Ограничения исследования. Следует отметить ряд ограничений представленного исследования, к которым можно отнести одноцентровый дизайн.
Согласно полученным результатам, частота пациентов, ответивших на СРТ, оказалась ниже данных других исследователей. Стоит подчеркнуть, что набор участников в исследование проводился с 2012г, по этой причине у части больных ответ на СРТ мог быть не достигнут по ряду объективных причин, связанных с несовершенством систем доставок, отсутствием квадриполярных электродов для стимуляции ЛЖ, особенностями программирования имплантированных устройств.
На частоту регистрации конечной точки могло оказать влияние и появление новых классов препаратов для лечения ХСН. Учитывая длительное наблюдение и отсутствие задач по строгому контролю и учету принимаемой терапии и анализу ее влияния на конечную точку, не представляется возможным указать точное число пациентов, получавших квадротерапию ХСН в ходе проспективного наблюдения. Отсутствие приема препаратов квадротерапии у всех больных, с одной стороны, является ограничением исследования. С другой стороны, исследование отражает реальную клиническую практику, для которой характерно отсутствие полного охвата больных ХСН квадротерапией, в т.ч. по причине выраженной артериальной гипотонии.
Заключение
В ходе проведенного исследования на основании исходных клинических, инструментальных и лабораторных данных, а также результатов проспективного однолетнего наблюдения были сформированы многофакторные прогностические системы, направленные на определение вероятности смерти по причине осложнений ССЗ у больных СНнФВ после установки ИКД с целью первичной профилактики ВСС. На основании полученных результатов был разработан ИЛР, предложено "отрезное значение" этого показателя, выше которого вероятность развития смерти по причине осложнений ССЗ у больных ХСН прогнозировалась с чувствительностью 85,7% и специфичностью 76,8%.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Список литературы
1. Zeppenfeld K, Tfelt-Hansen J, de Riva M, et al. 2022 ESC Guidelines for the management of patients with ventricular arrhythmias and the prevention of sudden cardiac death. Eur Heart J. 2022;43(40):3997-4126. doi:10.1093/eurheartj/ehac262.
2. Loungani RS, Teerlink JR, Metra M, et al. Cause of Death in Patients With Acute Heart Failure. JACC Heart Fail. 2020;8:999-1008. doi:10.1016/j.jchf.2020.09.010.
3. Лебедева В. К., Лебедев Д. С. Имплантируемый кардиовертер-дефибриллятор: принятие решения об отключении у пациентов с терминальной хронической сердечной недостаточностью. Российский кардиологический журнал. 2020;25(9):3868. doi:10.15829/1560-4071-2020-3868.
4. Галявич А. С., Терещенко С. Н., Ускач Т. М. и др. Хроническая сердечная недостаточность. Клинические рекомендации 2024. Российский кардиологический журнал. 2024;29(11):6162. doi:10.15829/1560-4071-2024-6162.
5. Barsheshet A, Moss AJ, Huang DT, et al. Applicability of a Risk Score for Prediction of the Long-Term (8-Year) Benefit of the Implantable Cardioverter-Defibrillator. J Am Coll Cardiol. 2012;59:2075-79. doi:10.1016/j.jacc.2012.02.036.
6. Bilchick KC, Wang Y, Cheng A, et al. Seattle Heart Failure and Proportional Risk Models Predict Benefit From Implantable Cardioverter-Defibrillators. J Am Coll Cardiol. 2017;69:2606-18. doi:10.1016/j.jacc.2017.03.568.
7. Younis A, Goldberger JJ, Kutyifa V, et al. Predicted benefit of an implantable cardioverter-defibrillator: the MADIT-ICD benefit score. Eur Heart J. 2021;42:1676-84. doi:10.1093/eurheartj/ehaa1057.
8. Илов Н. Н., Бойцов С. А., Нечепуренко А. А. Имплантиров ать дефибриллятор или нет? Возможности использования калькулятора MADIT-ICD Benefit Score в клинической практике. Кардиология. 2024;64(2):27-33. doi:10.18087/cardio.2024.2.n2447.
9. Butler J, Yang M, Manzi MA, et al. Clinical Course of Patients With Worsening Heart Failure With Reduced Ejection Fraction. J Am Coll Cardiol. 2019;73:935-44. doi:10.1016/j.jacc.2018.11.049.
10. Bardy GH, Lee KL, Mark DB, et al. Amiodarone or an Implantable Cardioverter–Defibrillator for Congestive Heart Failure. New England Journal of Medicine. 2005;352:225-37. doi:10.1056/NEJMoa043399.
11. Moss AJ, Zareba W, Hall WJ, et al. Prophylactic Implantation of a Defibrillator in Patients with Myocardial Infarction and Reduced Ejection Fraction. New England Journal of Medicine. 2002;346:877-83. doi:10.1056/NEJMoa013474.
12. Stein KM, Mittal S, Gilliam FR, et al. Predictors of early mortality in implantable cardioverter-defibrillator recipients. Europace. 2009;11:734-40. doi:10.1093/europace/eup055.
13. Barra S, Duehmke R, Providência R, et al. Very long-term survival and late sudden cardiac death in cardiac resynchronization therapy patients. Eur Heart J. 2019;40:2121-7. doi:10.1093/eurheartj/ehz238.
14. Britton KA, Gaziano JM, Djoussé L. Normal systolic blood pressure and risk of heart failure in US male physicians. Eur J Heart Fail. 2009;11:1129-34. doi:10.1093/eurjhf/hfp141.
15. Shen L, Claggett BL, Jhund PS, et al. Development and external validation of prognostic models to predict sudden and pump-failure death in patients with HFrEF from PARADIGM-HF and ATMOSPHERE. Clinical Research in Cardiology. 2021;110:1334-49. doi:10.1007/s00392-021-01888-x.
16. Ather S, Chan W, Chillar A, et al. Association of systolic blood pressure with mortality in patients with heart failure with reduced ejection fraction: A complex relationship. Am Heart J. 2011;161:567-73. doi:10.1016/j.ahj.2010.12.009.
17. Поляков Д. С., Фомин И. В., Бадин Ю. В. и др. Влияние уровня систолического и диастолического артериального давления и его динамики между последовательными госпитализациями на прогноз пациента с ХСН при острой декомпенсации. Журнал Сердечная Недостаточность. 2017;18(3):178-84. doi:10.18087/rhfj.2017.3.2357.
18. Ventura HO, Messerli FH, Lavie CJ. Observations on the blood pressure paradox in heart failure. Eur J Heart Fail. 2017;19:843-5. doi:10.1002/ejhf.818.
19. Oreopoulos A, Padwal R, Kalantar-Zadeh K, et al. Body mass index and mortality in heart failure: A meta-analysis. Am Heart J. 2008;156:13-22. doi:10.1016/j.ahj.2008.02.014.
20. Шпагина O. В., Бондаренко И. З. "Парадокс ожирения" — еще один взгляд на проблему сердечно-сосудистых заболеваний. Ожирение и Метаболизм. 2013;10(4):3-9. doi:10.14341/omet201343-9.
21. Bansal N, Zelnick LR, Ballantyne CM, et al. Upper Reference Limits for High-Sensitivity Cardiac Troponin T and N-Terminal Fragment of the Prohormone Brain Natriuretic Peptide in Patients With CKD. American Journal of Kidney Diseases. 2022;79:383-92. doi:10.1053/j.ajkd.2021.06.017.
22. Козиолова Н. А., Чернявина А. И. Риск развития хронической сердечной недостаточности в зависимости от структуры и субклинического поражения органов-мишеней у больных гипертонической болезнью. Российский кардиологический журнал. 2021;26(1):4257. doi:10.15829/1560-4071-2021-4257.
23. Değertekin M. NT-proBNP levels in stage 3-4 chronic kidney disease and mortality in long term follow Up: HAPPY study sub group analysis. Turk Kardiyoloji Dernegi Arsivi-Archives of the Turkish Society of Cardiology 2020. doi:10.5543/tkda.2020.57746.
24. McCallum W, Tighiouart H, Kiernan MS, et al. Relation of Kidney Function Decline and NT-proBNP With Risk of Mortality and Readmission in Acute Decompensated Heart Failure. Am J Med. 2020;133:115-22.e2. doi:10.1016/j.amjmed.2019.05.047.
25. Schrage B, Uijl A, Benson L, et al. Association Between Use of Primary-Prevention Implantable Cardioverter-Defibrillators and Mortality in Patients With Heart Failure. Circulation. 2019;140:1530-9. doi:10.1161/CIRCULATIONAHA.119.043012.
Об авторах
Н. Н. ИловРоссия
Илов Николай Николаевич — д.м.н., доцент, доцент кафедры сердечно-сосудистой хирургии; зав. отделом по обеспечению контроля качества.
Астрахань
Конфликт интересов:
Нет
О. В. Пальникова
Россия
Пальникова Олеся Викторовна — ассистент кафедры сердечно-сосудистой хирургии; врач-кардиолог отделения хирургического лечения сложных нарушений ритма сердца и электрокардиостимуляции.
Астрахань
Конфликт интересов:
Нет
Д. Р. Стомпель
Россия
Стомпель Динара Рафаиловна — ассистент кафедры сердечно-сосудистой хирургии; зав. отделением функциональной диагностики.
Астрахань
Конфликт интересов:
Нет
Д. А. Зорин
Россия
Зорин Дмитрий Андреевич — ассистент кафедры госпитальной терапии; врач-сердечно-сосудистый хирург отделения хирургического лечения сложных нарушений ритма сердца и электрокардиостимуляции.
Астрахань
Конфликт интересов:
Нет
Е. И. Романцов
Россия
Романцов Евгений Игоревич — врач-кардиолог отделения хирургического лечения сложных нарушений ритма сердца и электрокардиостимуляции.
Астрахань
Конфликт интересов:
Нет
М. Г. Терентьева
Россия
Терентьева Марина Геннадьевна — врач-кардиолог отделения хирургического лечения сложных нарушений ритма сердца и электрокардиостимуляции.
Астрахань
Конфликт интересов:
Нет
А. М. Абдулкадыров
Россия
Абдулкадыров Альберт Мурасбикович — врач-кардиолог отделения хирургического лечения сложных нарушений ритма сердца и электрокардиостимуляции.
Астрахань
Конфликт интересов:
Нет
Д. Р. Паскеев
Россия
Паскеев Дамир Равильевич — врач-кардиолог отделения хирургического лечения сложных нарушений ритма сердца и электрокардиостимуляции.
Астрахань
Конфликт интересов:
Нет
Е. А. Куликова
Россия
Куликова Елена Александровна — врач-кардиолог отделения хирургического лечения сложных нарушений ритма сердца и электрокардиостимуляции.
Астрахань
Конфликт интересов:
Нет
Д. О. Климчук
Россия
Климчук Денис Олегович — врач-кардиолог отделения хирургического лечения сложных нарушений ритма сердца и электрокардиостимуляции.
Астрахань
Конфликт интересов:
Нет
О. В. Петрова
Россия
Петрова Ольга Владимировна — профессор кафедры сердечно-сосудистой хирургии, зав. клинико-диагностической лабораторией, врач клинической лабораторной диагностики.
Астрахань
Конфликт интересов:
Нет
А. А. Нечепуренко
Россия
Нечепуренко Анатолий Анатольевич — к.м.н., зав. отделением хирургического лечения сложных нарушений ритма сердца и электрокардиостимуляции.
Астрахань
Конфликт интересов:
Нет
В. Н. Колесников
Россия
Колесников Владимир Николаевич — к.м.н., главный врач.
Астрахань
Конфликт интересов:
Нет
С. А. Бойцов
Россия
Бойцов Сергей Анатольевич — д.м.н., профессор, академик РАН, генеральный директор.
Москва
Конфликт интересов:
Нет
Дополнительные файлы
Что уже известно о предмете исследования?
- Применение имплантируемых кардиовертеров-дефибрилляторов (ИКД) противопоказано при высоком однолетнем риске смерти.
- Общепризнанные инструменты стратификации такого риска у больных сердечной недостаточностью со сниженной фракцией выброса левого желудочка (СНнФВ) отсутствуют.
Что нового?
- Впервые в стране предложен алгоритм оценки риска смерти от осложнений сердечно-сосудистых заболеваний у больных СНнФВ в ближайший год после установки ИКД.
Возможный вклад в клиническую практику
- Разработанный прогностический индекс может быть использован для разработки персонифицированной стратегии проведения интервенционной первичной профилактики внезапной сердечной смерти.
Рецензия
Для цитирования:
Илов Н.Н., Пальникова О.В., Стомпель Д.Р., Зорин Д.А., Романцов Е.И., Терентьева М.Г., Абдулкадыров А.М., Паскеев Д.Р., Куликова Е.А., Климчук Д.О., Петрова О.В., Нечепуренко А.А., Колесников В.Н., Бойцов С.А. Индекс летального риска — новый инструмент прогнозирования однолетней летальности больных хронической сердечной недостаточностью со сниженной фракцией выброса левого желудочка. Российский кардиологический журнал. 2025;30(6):6222. https://doi.org/10.15829/1560-4071-2025-6222. EDN: ILTPGD
For citation:
Ilov N.N., Palnikova O.V., Stompel D.R., Zorin D.A., Romantsov E.I., Terentyeva M.G., Abdulkadyrov A.M., Paskeev D.R., Kulikova E.A., Klimchuk D.O., Petrova O.V., Nechepurenko A.A., Kolesnikov V.N., Boytsov S.A. Lethal risk index — a novel tool for predicting one-year mortality in patients with heart failure with reduced ejection fraction. Russian Journal of Cardiology. 2025;30(6):6222. (In Russ.) https://doi.org/10.15829/1560-4071-2025-6222. EDN: ILTPGD

















































