Перейти к:
Сравнение коронарного шунтирования и стентирования в зависимости от клиникоанатомического сценария по результатам ретроспективного одноцентрового когортного исследования
https://doi.org/10.15829/1560-4071-2025-6092
EDN: GAAMJK
Аннотация
Цель. Оценить отдаленную общую летальность после чрескожного коронарного вмешательства (ЧКВ) и коронарного шунтирования (КШ) у больных стабильной ишемической болезнью сердца (ИБС) при различных клиникоанатомических сценариях.
Материал и методы. В одноцентровом когортном ретроспективном исследовании проводилась оценка результатов КШ и ЧКВ с имплантацией стентов с лекарственным покрытием 2-го поколения у 4177 больных стабильной ИБС. Оценивалась частота госпитальной и 30-дневной смерти, отдаленной общей летальности в срок до 5 лет после вмешательства (средний период наблюдения — 38 мес.). Также оценивалось влияние исходной тяжести поражения коронарных артерий, наличия/отсутствия сахарного диабета (СД), сократительной способности миокарда на отдаленную общую летальность после реваскуляризации миокарда.
Результаты. Госпитальные и 30-дневные риски смерти больных, перенесших ЧКВ и КШ, после сопоставления исходных клинических характеристик статистически значимо не различались. В отдаленном периоде наблюдения выполнение ЧКВ в сравнении с КШ сопровождалось увеличением риска смерти от любых причин в основных группах (ЧКВ против КШ: отношение рисков (ОР) 1,84, 95% доверительный интервал (ДИ): 1,30-2,62, р<0,001), а также в подгруппах: (1) у больных с многососудистым поражением коронарных артерий (ОР 1,77, 95% ДИ: 1,19-2,64, р=0,005), (2) у больных с поражением ствола левой коронарной артерии >50% (ОР 5,04, 95% ДИ: 1,72-14,76, р=0,003), но не у больных с однососудистым поражением (ОР 2,084, 95% ДИ: 0,996-4,361, р=0,051).
Наличие СД в основных группах исследования не влияло на различие в смертности: КШ имело преимущество над ЧКВ вне зависимости от наличия диабета. Однако проведение КШ у больных с многососудистым поражением и СД, в отличие от больных без диабета, приводило к достоверному снижению риска общей смерти (ОР 2,29, 95% ДИ: 1,173-4,47, р=0,015). Также проведение ЧКВ в сравнении с КШ сопровождалось повышением 5-летнего риска смерти у больных с не сниженной общей фракцией выброса левого желудочка (ОФВ ЛЖ) >40% (ОР 1,74, 95% ДИ: 1,205-2,536, р=0,003), но не у больных с ОФВ ЛЖ <40% (95% ДИ: 1,314-4,709, р=0,809).
Заключение. Полученные данные свидетельствуют о достоверном снижении 5-летнего риска общей смерти при проведении КШ в сравнении с больными после ЧКВ. Потенциальную долгосрочную пользу от КШ в сравнении с ЧКВ могут получить пациенты со сложным поражением коронарных артерий (стеноз ствола левой коронарной артерии >50%, поражение ³2 коронарных артерий), с сопутствующим диабетом при многососудистом поражении и больные с не сниженной ОФВ ЛЖ (>40%).
Ключевые слова
Для цитирования:
Голухова Е.З., Сигаев И.Ю., Керен М.А., Завалихина Т.В., Петросян К.В., Яхяева К.Б., Волковская И.В., Авакова С.А. Сравнение коронарного шунтирования и стентирования в зависимости от клиникоанатомического сценария по результатам ретроспективного одноцентрового когортного исследования. Российский кардиологический журнал. 2025;30(4):6092. https://doi.org/10.15829/1560-4071-2025-6092. EDN: GAAMJK
For citation:
Golukhova E.Z., Sigaev I.Yu., Keren M.A., Zavalikhina T.V., Petrosyan K.V., Yakhyaeva K.B., Volkovskaya I.V., Avakova S.A. Comparison of coronary artery bypass grafting and stenting depending on the clinical and anatomical scenario: data from the retrospective single-center cohort study. Russian Journal of Cardiology. 2025;30(4):6092. (In Russ.) https://doi.org/10.15829/1560-4071-2025-6092. EDN: GAAMJK
На сегодняшний день ишемическая болезнь сердца (ИБС) является лидирующей причиной смерти среди населения Российской Федерации. Несмотря на приоритет медикаментозного подхода в лечении ИБС, остаётся немалая доля больных, требующих эндоваскулярного или хирургического вмешательства. Коронарное шунтирование (КШ) и чрескожное коронарное вмешательство (ЧКВ) являются безопасными и эффективными методами реваскуляризации миокарда. Текущие клинические рекомендации свидетельствуют, что оба вмешательства представляют собой варианты выбора при стабильной ИБС, однако КШ имеет более высокий уровень рекомендации для большинства клинических сценариев [1]. При этом важно отметить, что число выполняемых ЧКВ значительно превышает число КШ [2]. Рекомендации по выбору вида реваскуляризации у больных со стабильной ИБС указывают, что при более тяжелых поражениях коронарных артерий по Syntax Score приоритеты имеет КШ, а при более легких — ЧКВ [1]. При этом очевидно, что имеется большое число больных ИБС, которым можно выполнить оба типа вмешательства.
В то же время известно, что КШ имеет значительные долгосрочные преимущества перед ЧКВ у больных ИБС с сахарным диабетом (СД) и сложным, в т. ч. стволовым, поражением коронарных артерий. Несмотря на это, рутинное использование стентов с лекарственным покрытием (ЛП) второго поколения привело к значительному улучшению клинических исходов ЧКВ за счет снижения рисков рестеноза и тромбоза стента, по сравнению со стентами первого поколения [3]. При этом исследования, сравнивающие сердечно-сосудистые исходы КШ с ЧКВ с использованием стентов с ЛП второго поколения, все еще ограничены, в особенности у больных с многососудистым коронарным поражением [4].
Наблюдаемый в мире тренд в сторону снижения объемов инвазивных коронарных вмешательств, вероятно, обусловлен современными достижениями медикаментозного лечения ИБС и результатами последних исследований, что свидетельствует о необходимости дополнительного изучения целесообразности проведения реваскуляризации у определённых групп пациентов при стабильной ИБС в аспекте ее влияния на выживаемость [5]. Целью нашего исследования являлось оценить отдалённую общую летальность после ЧКВ и КШ у больных стабильной ИБС при различных клинико-анатомических сценариях.
Материал и методы
В рамках одноцентрового когортного ретроспективного исследования проводилась оценка результатов КШ и ЧКВ у больных ИБС, оперированных за период 01.09.2018 по 01.08.2021. Для этого из автоматизированной истории болезни были выгружены данные пациентов, соответствовавших критериям включения. Критериями включения являлись перенесенные изолированные КШ или ЧКВ с имплантацией стентов 2-го поколения, как результат госпитализации у больных со стабильным течением ИБС. В исследование не включали пациентов, перенесших КШ, одномоментно с другим вмешательством на сердце и/или сосудах, а также пациентов, перенесших имплантацию стентов без ЛП или с покрытием 1-го поколения или перенесших баллонную ангиопластику без имплантации стента. После применения выше указанных критериев в исследование было включено 4177 больных ИБС, впоследствии разделенных на 2 группы в зависимости от типа вмешательства: 1 группа — перенесшие ЧКВ (n=1354), 2 группа — перенесшие КШ (n=2823). Принятие решения относительно метода реваскуляризации зависело от решения Кардиокоманды и пациента.
КШ проводили по стандартной методике через срединную стернотомию, при этом выбор тактики КШ (с искусственным кровообращением (67,2%, n=466) или на работающем сердце (32,8%, n=227)) осуществлялся по усмотрению оперирующего хирурга. Шунтирование передней нисходящей артерии с использованием левой внутренней грудной артерии было выполнено у 90,5% (n=627). Среднее число сформированных шунтов в расчете на пациента составило 2,5 (2,0-3,0).
ЧКВ проводили по стандартной методике через радиальный доступ. При ЧКВ проводили имплантацию стентов, покрытых зотаролимусом. Среднее число имплантируемых стентов на пациента составило 2,0 (1,0-3,0).
Исследование было выполнено в соответствии со стандартами надлежащей клинической практики (Good Clinical Practice) и принципами Хельсинкской декларации. Протокол исследования был одобрен Этическим комитетом ФГБУ НМИЦ ССХ им. А. Н. Бакулева Минздрава России. Клинические, ангиографические и постпроцедурные данные были собраны из больничных карт и медицинских информационных систем.
Конечной точкой исследования являлась смерть от любых причин от момента выполнения вмешательства до окончательной даты сбора данных об исходе (29.12.2023). Отдаленный срок наблюдения, рассчитанный от 30-дневных исходов, составил от 2 до 71 мес. Средний общий период наблюдения составил 38,0 (30,0-51,0) мес.
Также проводили внутригрупповой анализ, при котором оценивалось влияние тяжести поражения коронарных артерий (поражение ствола левой коронарной артерии (ЛКА), многососудистое поражение (≥2 коронарных артерий)), наличия/отсутствия СД, фракции выброса левого желудочка на отдаленную общую летальность после ЧКВ и КШ.
Исходные характеристики сравниваемых групп свидетельствовали о существенной клинической разнородности, вследствие чего нами проводилась псевдорандомизация (Propensity Score Matching (PSM)) с использованием метода поиска "ближайшего соседа" в отношении подбора пар 1:1 для достижения полной сопоставимости групп по сравниваемым признакам (табл. 1). Дальнейший анализ и расчеты проводили на сопоставимых группах с помощью пакета программ: StatTech v. 4.2.7 (Россия) и IBM SPS Statistics 26.0 (США). Нормальность распределения количественных показателей осуществлялась с помощью критерия Колмогорова-Смирнова. В случае отсутствия нормального распределения количественные данные описывались с помощью медианы (Me) и нижнего и верхнего квартилей [Q1-Q3]. Категориальные данные описывались с указанием абсолютных значений и процентных долей. При анализе четырехпольных таблиц сопряженности для сравнения долей применяли критерий χ2 (хи-квадрат) Пирсона. Сравнение двух групп по количественному показателю, распределение которого отличалось от нормального, выполнялось с помощью U-критерия Манна-Уитни. Оценка функции общей выживаемости проводилась с помощью анализа выживаемости по Каплану-Мейеру. Оценка влияния вида реваскуляризации на риск развития отдаленной летальности проводилась по методу регрессии Кокса с расчетом отношения рисков (ОР) с 95% доверительным интервалом (ДИ). Различия показателей считались статистически значимыми при уровне значимости p<0,05.
Таблица 1
Исходная характеристика сравниваемых групп до и после проведения псевдорандомизации
|
До псевдорандомизации |
После псевдорандомизации |
|||||
|
1 группа, ЧКВ (n=1354) |
2 группа, КШ (n=2823) |
p-value |
1 группа, ЧКВ (n=693) |
2 группа, КШ (n=693) |
p-value |
|
|
Возраст, годы |
65,1 (58,7-70,9) |
63,7 (58,0-68,7) |
<0,001* |
64,8 (58,0-70,7) |
64,7 (58,8-69,3) |
0,690 |
|
Женский пол |
389 (28,7) |
582 (20,6) |
<0,001* |
175 (25,3) |
184 (26,6) |
0,581 |
|
Мужской пол |
965 (71,3) |
2241 (79,4) |
518 (74,7) |
509 (73,4) |
||
|
ИМ в анамнезе |
630 (46,5) |
1619 (57,4) |
<0,001* |
362 (52,2) |
346 (49,9) |
0,390 |
|
Артериальная гипертензия |
1249 (92,2) |
2661 (94,3) |
0,013* |
646 (93,2) |
652 (94,1) |
0,509 |
|
СД 2 типа |
361 (26,7) |
777 (27,5) |
0,558 |
183 (26,4) |
179 (25,8) |
0,807 |
|
— инсулиннезависимый СД — инсулинозависимый СД |
324 (23,9) 37 (2,7) |
674 (23,9) 103 (3,6) |
0,303 |
160 (23,1) 23 (3,3) |
154 (22,2) 25 (3,6) |
0,899 |
|
Средний ИМТ, кг/м2 |
29,7 (26,6-32,8) |
28,7 (26,0-32,0) |
<0,001* |
29,04 (26,0-32,3) |
29,0 (26,4-32,9) |
0,317 |
|
Курильщики |
422 (31,2) |
992 (35,1) |
0,011* |
234 (33,8) |
226 (32,6) |
0,648 |
|
ОФВ ЛЖ, % |
57,0 (52,0-61,0) |
56,0 (52,0-59,0) |
<0,001* |
57,0 (51,9-60,4) |
57,0 (53,4-59,0) |
0,419 |
|
Критическое поражение каротидных артерий ≥70% |
137 (10,1) |
322 (11,4) |
0,213 |
81 (11,7) |
59 (8,5) |
0,052 |
|
Критическое поражение магистральных артерий нижних конечностей ≥70% |
107 (7,9) |
372 (13,2) |
<0,001* |
65 (9,4) |
65 (9,4) |
1,000 |
|
СКФ, мл/мин/1,73 м2 |
76,5 (64,3-88,5) |
80,3 (68,7-92,3) |
<0,001* |
77,7 (65,3-88,8) |
79,1 (67,5-91,2) |
0,058 |
|
КШ в анамнезе |
221 (16,3) |
60 (2,1) |
<0,001* |
53 (7,6) |
42 (6,1) |
0,242 |
|
ЧКВ в анамнезе |
673 (49,7) |
821 (29,1) |
<0,001* |
315 (45,5) |
299 (43,1) |
0,387 |
|
Поражение ствола ЛКА >50% |
155 (11,4) |
835 (29,6) |
<0,001* |
106 (15,3) |
103 (14,9) |
0,822 |
|
Однососудистое поражение КА |
633 (46,8) |
257 (9,1) |
<0,001* |
178 (25,7) |
188 (27,1) |
0,542 |
|
Двухсосудистое поражение КА |
450 (33,2) |
900 (31,9) |
0,381 |
301 (43,4) |
304 (43,9) |
0,871 |
|
Трехсосудистое поражение КА |
271 (20,0) |
1663 (58,9) |
<0,001* |
214 (30,9) |
201 (29,0) |
0,446 |
Примечание: * — статистически значимое значение.
Сокращения: ИМ — инфаркт миокарда, ИМТ — индекс массы тела, КА — коронарная артерия, КШ — коронарное шунтирование, ЛКА — левая коронарная артерия, ОФВ ЛЖ — общая фракция выброса левого желудочка, СД — сахарный диабет, СКФ — скорость клубочковой фильтрации, ЧКВ — чрескожное коронарное вмешательство.
Результаты
Ближайшие результаты после ЧКВ и КШ. На исходной выборке (до псевдорандомизации) госпитальная летальность после КШ была значимо выше, чем после ЧКВ, однако после псевдорандомизации групп различие перестало быть значимым (0,7% и 1,0% после ЧКВ и КШ, соответственно, р=0,773) (табл. 2). 30-дневная летальность после ЧКВ и КШ также статистически значимо не различалась (0,7% и 1,2%, после ЧКВ и КШ, соответственно, р=0,421).
За период от 30 дней до конечной даты наблюдения умерло 138 пациентов (89/638 — после ЧКВ, 49/678 — после КШ). Отдаленная летальность от любых причин после КШ составила 12,4%, после ЧКВ — 17% (р=0,001) (рис. 1).
Отдаленные результаты после ЧКВ и КШ
1) В основных группах
Статистически значимое расхождение кривых в пользу КШ имело место, начиная с первого года наблюдения (р=0,007), и сохранялось на протяжении всего периода наблюдения. Проведение ЧКВ в сравнении с КШ сопровождалось увеличением отдаленного риска смерти в исследуемых группах (ОР 1,848, 95% ДИ: 1,30-2,62, р<0,001). При этом снижение риска смерти после КШ имело место вне зависимости от наличия СД и у больных с общей фракцией выброса левого желудочка (ОФВ ЛЖ) >40%, но не наблюдалось у больных с ОФВ ЛЖ <40% (табл. 3). В дальнейшем мы проанализировали влияние различных клинико-анатомических сценариев на частоту общей смерти в исследуемых группах.
2) В подгруппах
Среди больных с многососудистым поражением в отдаленном периоде после ЧКВ умерло 68 (7,7%) больных, после КШ — 38 (13,5%) больных (ОР 1,77, 95% ДИ: 1,194-2,643, р=0,005). Среди больных с поражением ствола ЛКА после ЧКВ умерло 20 (19,4%), после КШ — 4 (4%) больных (ОР 5,046, 95% ДИ: 1,724-14,766, р=0,003). При однососудистом коронарном поражении риск смерти после КШ и ЧКВ не достиг статистически значимых различий (р=0,051) (табл. 3).
В общей группе пациентов преимущество КШ перед ЧКВ было получено вне зависимости от наличия СД (табл. 3). При этом при наличии СД риск смерти после ЧКВ был выше, чем после КШ (при наличии СД: ОР 2,488, р=0,005, без СД: ОР 1,626, р=0,023).
У больных с многососудистым поражением и сопутствующим СД риск смерти после ЧКВ был выше, чем после КШ (ОР 2,39, р=0,015). Также следует подчеркнуть, что при наличии СД у больных с поражением ствола ЛКА риск смерти после ЧКВ, в сравнении с КШ, возрастал в 6,269 раза (р=0,049), что значительно выше, чем у стволовых больных без СД (ОР 3,461, р=0,030).
У больных с не сниженной ОФВ ЛЖ >40% также наблюдалось преимущество КШ перед ЧКВ: проведение ЧКВ сопровождалось увеличением отдаленного риска смерти в 1,74 раза в сравнении с КШ (р=0,003), в 1,63 раза — в группе с многососудистым поражением (р=0,025) и 6,22 раза — в группе с поражением ствола ЛКА (p=0,004). Среди больных со сниженной ОФВ ЛЖ значимых различий в отношении риска смерти не было выявлено вне зависимости от вида вмешательства (табл. 3).
Таблица 2
Ближайшая и отдаленная общая летальность после ЧКВ и КШ
|
До псевдорандомизации |
После псевдорандомизации |
|||||
|
1 группа, ЧКВ (n=1354) |
2 группа, КШ (n=2823) |
p-value |
1 группа, ЧКВ (n=693) |
2 группа, КШ (n=693) |
p-value |
|
|
Госпитальная летальность |
7 (0,5) |
41 (1,5) |
0,008* |
5 (0,7) |
7 (1,0) |
0,773 |
|
30-дневная летальность |
8 (0,6) |
29 (1,0) |
0,152 |
5 (0,7) |
8 (1,2) |
0,421 |
|
Отдаленная общая летальность |
145 (10,8) |
252 (9,1) |
0,081 |
89 (12,9) |
49 (7,2) |
<0,001* |
Примечание: * — статистически значимое значение.
Сокращения: КШ — коронарное шунтирование, ЧКВ — чрескожное коронарное вмешательство.
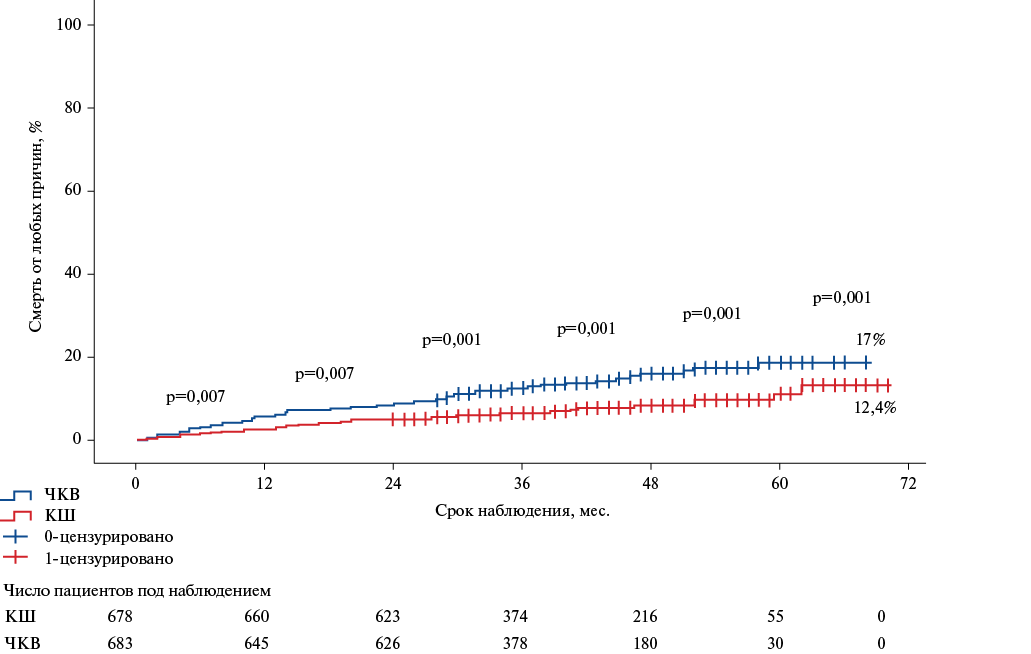
Рис. 1. Сравнение 5-летней общей смертности после КШ и ЧКВ.
Сокращения: КШ — коронарное шунтирование, ЧКВ — чрескожное коронарное вмешательство.
Таблица 3
Риск отдаленной смерти после ЧКВ и КШ в зависимости от клинико-анатомического сценария
|
Все пациенты |
Однососудистое поражение КА |
Многососудистое поражение КА |
Поражение ствола ЛКА >50% |
||||||||||||||||||
|
ЧКВ |
КШ |
ОР |
95% ДИ |
p-value |
ЧКВ |
КШ |
ОР |
95% ДИ |
p-value |
ЧКВ |
КШ |
ОР |
95% ДИ |
p-value |
ЧКВ |
КШ |
ОР |
95% ДИ |
p-valuе |
||
|
Все |
13,0% 89/683 |
7,2% 49/678 |
1,848 |
1,303-2,621 |
<0,001* |
11,8% 21/178 |
6,0% 11/184 |
2,084 |
0,996-4,361 |
0,051 |
13,5% 68/505 |
7,7% 38/494 |
1,777 |
1,194-2,643 |
0,005* |
19,4% 20/103 |
4,0% 4/100 |
5,046 |
1,724-14,766 |
0,003* |
|
|
Сахарный диабет |
Да |
17,4% 31/178 |
8,1% 14/172 |
2,488 |
1,314-4,709 |
0,005* |
12,8% 5/39 |
3,4% 1/29 |
52,428 |
0,036-75,387 |
0,286 |
18,7% 26/139 |
9,1% 13/143 |
2,290 |
1,173-4,471 |
0,015* |
21,4% 6/28 |
5% 1/20 |
6,269 |
1,001-51,553 |
0,049* |
|
Нет |
11,5% 58/505 |
6,9% 35/506 |
1,626 |
1,069-2,474 |
0,023* |
11,5% 16/139 |
6,5% 10/155 |
1,674 |
0,759-3,693 |
0,202 |
11,5% 42/366 |
7,1% 25/351 |
1,582 |
0,964-2,597 |
0,069 |
17,3% 14/75 |
5,0% 3/80 |
3,461 |
1,128-10,620 |
0,030* |
|
|
ФВ ЛЖ ≤40% |
Да |
32,0% 16/50 |
40,0% 4/10 |
0,873 |
0,291-2,621 |
0,809 |
14,3% 2/14 |
25,0% 1/4 |
0,933 |
0,077-11,336 |
0,956 |
38,9% 14/36 |
50,0% 3/6 |
0,716 |
0,205-2,495 |
0,600 |
33,3% 3/9 |
100% 1/1 |
0,252 |
0,023-2,784 |
0,261 |
|
Нет |
11,5% 73/633 |
6,7% 45/668 |
1,748 |
1,205-2,536 |
0,003* |
11,6% 19/164 |
5,6% 10/180 |
2,163 |
0,996-4,698 |
0,051 |
11,5% 54/469 |
7,2% 35/488 |
1,629 |
1,064-2,493 |
0,025* |
18,1% 17/94 |
3,0% 3/99 |
6,225 |
1,824-21,247 |
0,004* |
|
Примечание: * — статистически значимое значение.
Сокращения: ДИ — доверительный интервал, КА — коронарная артерия, КШ — коронарное шунтирование, ЛКА — левая коронарная артерия, ОР — отношение рисков, ФВ ЛЖ — фракция выброса левого желудочка, ЧКВ — чрескожное коронарное вмешательство.
Обсуждение
Относительные преимущества КШ перед ЧКВ являются предметом неутихающих споров при принятии решения о выборе оптимального вида коронарной реваскуляризации. В нашем исследовании на основании анализа пятилетних исходов у 4177 больных, перенесших КШ (n=2823) или ЧКВ с имплантацией стента с ЛП 2-го поколения (n=1354), были получены данные об уверенном долгосрочном преимуществе КШ при большинстве клинико-анатомических сценариев.
Интересно, что несмотря на более высокий операционный риск при открытых вмешательствах на сердце, госпитальные и 30-дневные риски смерти после ЧКВ и КШ, рассчитанные после достижения клинического равновесия методом псевдорандомизации, статистически значимо не различались, что подчеркивает безопасность обоих вмешательств среди больных сопоставимого операционного риска.
В отдаленном периоде наблюдения выполнение ЧКВ, в сравнении с КШ, сопровождалось увеличением риска смерти от любых причин в 1,84 раза (р<0,001). Таким образом, в исследуемой выборке имплантация стентов с ЛП 2-го поколения не обеспечивала преимущества в снижении риска смерти от любых причин после ЧКВ, в сравнении с КШ, что совпадает с рядом мнений об улучшении исходов (снижения частоты инфаркта миокарда, повторных реваскуляризаций) без влияния на общую летальность при использовании ЛП 2-го поколения при ЧКВ [6].
Между тем, у больных ИБС, которым технически можно выполнить как ЧКВ, так и КШ, именно особенность клинического статуса (высокий операционный риск, сложность коронарной анатомии, наличие СД, сократительная способность миокарда и пр.) и является решающим фактором при принятии решения, т. к. может определить исход и прогноз вмешательства.
В анализируемой нами выборке наличие многососудистого коронарного поражения и стеноза ствола ЛКА являлось критериями в пользу проведения КШ, что подтверждается результатами других исследований [7][8].
Известно, что выполнение КШ у больных с СД и многососудистым коронарным поражением имеет долгосрочные преимущества перед эндоваскулярным лечением [1]. В нашем исследовании в общей группе больных преимущество КШ не зависело от сопутствующего СД, что можно объяснить 1) малым числом больных с инсулинозависимым СД, который считается более мощным предиктором неблагоприятных исходов после КШ, чем инсулиннезависимые формы СД [9], и 2) наличием в общей выборке пациентов, перенесших однососудистую реваскуляризацию (ЧКВ или КШ), что могло также повлиять на результат. При многососудистом поражении без диабета различие в смертности между ЧКВ и КШ не достигло значимости (р=0,69), однако при наличии СД различие было в пользу КШ (ОР 2,3, р=0,015).
Ранее сообщалось об улучшении общей выживаемости у больных со сниженной ОФВ ЛЖ после реваскуляризации миокарда [10][11]. При этом было показано, что КШ имеет преимущество перед ЧКВ (отношение шансов — 0,82, 95% ДИ: 0,75-0,90, р<0,001) [10].
Как было показано [12], наличие полностью жизнеспособного миокарда ЛЖ сопровождалось некоторым снижением риска смерти от всех причин после ЧКВ. Однако в случае дисфункции миокарда при сохранной жизнеспособности, ЧКВ не приводило к снижению рисков смерти. Объём рубцового поражения являлся основным не благоприятным для прогноза после ЧКВ фактором: риск смерти увеличивался на 18% на каждые 10% объема рубца [13]. В проведенном нами исследовании ни один из методов реваскуляризации не обеспечивал преимущество в улучшении отдаленной выживаемости у больных со сниженной ОФВ ЛЖ (<40%). Ввиду ограничений исследования (отсутствия доступных данных о выраженности рубцового поражения и жизнеспособного миокарда в исследуемых группах) объяснить полученный результат представляется сложно выполнимой задачей, однако стоит учесть, что исходно 52,2% больных после ЧКВ и 49,9% после КШ (табл. 1) имели постинфарктные изменения миокарда, что, по-видимому, могло внести свой вклад в полученный нами результат.
Другими существенными ограничениями исследования, обусловленными ретроспективным дизайном, является отсутствие доступных данных об исходной сложности коронарного поражения по SyntaxScore и его остаточном значении, а также об оптимальности проводимой медикаментозной терапии. Также важным является необходимость оценки не только общей, но и сердечно-сосудистой смерти у больных после КШ и ЧКВ. Кроме того, необходимо учитывать высокую частоту повторных эндоваскулярных вмешательств в нашем исследовании (до половины больных ранее переносили ЧКВ по данным анамнеза (табл. 1)), что также сопряжено с дополнительным увеличением риска. Наличие эндоваскулярных коронарных вмешательств в анамнезе у больных в группе ЧКВ сопровождалось повышением риска наступления отдаленной смерти в 2,6 раза в сравнении с группой КШ (14,6% и 6,2% в группах после ЧКВ и КШ, соответственно, ОР 2,643, 95% ДИ: 1,493-4,674, р=0,001). Учет всех выше указанных аспектов представляется необходимым для понимания механизмов, приводящих к улучшению прогноза после реваскуляризации миокарда, и может вносить значимый вклад в оценку эффективности каждого из методов реваскуляризации.
Данное исследование демонстрирует уверенный приоритет КШ перед ЧКВ с имплантацией стентов 2-го поколения при большинстве клинико-анатомических сценариев. При этом остается ключевой вопрос, требующий ответа: чем обеспечено данное преимущество? Одним из возможных объяснений может быть более низкое достижение полноты реваскуляризации при ЧКВ у больных с многососудистым поражением. В исследовании SYNTAX [12] было показано, что на практике достижение полной анатомической реваскуляризации при ЧКВ происходит реже, чем при КШ (56,7 и 63,2% после ЧКВ и КШ, соответственно, р=0,001). При этом особо остро эта проблема стоит у больных с многососудистым поражением и при поражении ствола ЛКА [14].
Другим возможным объяснением отдаленного преимущества КШ перед ЧКВ является теория "хирургической коллатерализации" при КШ. Как показывают результаты исследований, наступление спонтанного острого инфаркта миокарда (ОИМ) ассоциируется больше с не критическими стенозами в коронарных артериях. Между тем, современная практика ЧКВ базируется на стентировании поток-лимитирующего стеноза коронарной артерии, которые не так часто являются причиной ОИМ. В отличие от ЧКВ, КШ приводит к так называемой "коллатерализации", за счет того шунт, пришитый дистальнее всех стенозов, способен обойти все поражения (независимо от их степени), в т. ч. потенциально вызывающие ОИМ. Таким образом, выполнение КШ обеспечивает наибольшую защиту от спонтанного ОИМ, особенно когда число атеросклеротических бляшек, а, следовательно, и риски ОИМ, высоки [14]. Можно допустить, что стратегии лечения хронической ИБС, снижающие частоту ОИМ, будут снижать и летальность от ИБС в целом.
При этом следует отметить, что теория "хирургической коллатерализации" противоречит концепции реваскуляризации стенозов на основании измерения фракционного резервного кровотока, а, следовательно, требует дополнительного изучения [15].
Заключение
В проведенном нами исследовании были получены данные, свидетельствующие об уверенном преимуществе КШ над ЧКВ в отношении снижения отдаленного общего риска смерти у больных со сложным поражением коронарных артерий. Отдаленная летальность после КШ была значимо ниже среди больных с многососудистым поражением коронарных артерий при наличии СД, больных с поражением ствола ЛКА вне зависимости от диабета и больных с не сниженной ОФВ (>40%). Не было получено различий в частоту смерти после ЧКВ и КШ у больных с однососудистым коронарным поражением и у больных со сниженной ОФВ ЛЖ. При выборе стратегии реваскуляризации важно учитывать тяжесть поражения коронарных артерий, состояние сократительной способности миокарда и наличие сопутствующего диабета.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Список литературы
1. Стабильная ишемическая болезнь сердца. Клинические рекомендации 2020. Российский кардиологический журнал. 2020;25(11):4076. doi:10.15829/1560-4071-2020-4076.
2. Голухова Е.З. Аортокоронарное шунтирование и чрескожное коронарное вмешательство при стабильной ишемической болезни сердца: современный этап. Креативная кардиология. 2019;13(2):91-7. doi:10.24022/1997-3187-2019-13-2-91-97.
3. Sarno G, Lagerqvist B, Fröbert O, et al. Lower risk of stent thrombosis and restenosis with unrestricted use of ‘new-generation' drug-eluting stents: a report from the nationwide Swedish Coronary Angiography and Angioplasty Registry (SCAAR). Eur Heart J. 2012;33:606-13. doi:10.1093/eurheartj/ehr479.
4. Park SJ, Ahn JM, Kim YH, et al. Trial of everolimus-eluting stents or bypass surgery for coronary disease. N Engl J Med. 2015;372:1204-12. doi:10.1056/NEJMoa1415447.
5. Сигаев И.Ю., Керен М.А. Показания, критерии, выбор метода реваскуляризации миокарда: данные европейских и российских клинических рекомендаций. Креативная кардиология. 2018;12(2):167-76. doi:10.24022/1997-3187-2018-12-2-167-176.
6. Kufner S, Joner M, Thannheimer A, et al. Ten-Year Clinical Outcomes From a Trial of Three Limus-Eluting Stents With Different Polymer Coatings in Patients With Coronary Artery Disease. Circulation. 2019;139(3):325-33. doi:10.1161/CIRCULATIONAHA.118.038065.
7. Chew NWS, Koh JH, Ng CH, et al. Coronary Artery Bypass Grafting Versus Percutaneous Coronary Intervention for Multivessel Coronary Artery Disease: A One-Stage MetaAnalysis. Front Cardiovasc Med. 2022;9:822228. doi:10.3389/fcvm.2022.822228.
8. De Filippo O, Di Franco A, Boretto P, et al. Percutaneous coronary intervention versus coronary artery surgery for left main disease according to lesion site: A meta-analysis. J Thorac Cardiovasc Surg. 2023;166(1):120-32.e11. doi:10.1016/j.jtcvs.2021.08.040.
9. Wang R, Serruys PW, Gao C, et al. Ten-year all-cause death after percutaneous or surgical revascularization in diabetic patients with complex coronary artery disease. Eur Heart J. 2021;43(1):56-67. doi:10.1093/eurheartj/ehab441.
10. Wolff G. Survival Benefits of Invasive Versus Conservative Strategies in Heart Failure in Patients With Reduced Ejection Fraction and Coronary Artery Disease: A Meta-Analysis. Circ Heart Fail. 2017;10(1):e003255. doi:10.1161/CIRCHEARTFAILURE.116.003255.
11. Golukhova EZ, Slivneva IV, Kozlova OS, et al. Treatment Strategies for Chronic Coronary Heart Disease with Left Ventricular Systolic Dysfunction or Preserved Ejection Fraction-A Systematic Review and Meta-Analysis. Pathophysiology. 2023;30(4):640-58. doi:10.3390/pathophysiology30040046.
12. Serruys PW, Morice MC, Kappetein AP, et al. Percutaneous coronary intervention versus coronary-artery bypass grafting for severe coronary artery disease. N Engl J Med. 2013; 7;368(6):584. doi:10.1056/NEJMoa0804626.
13. Perera D, Clayton T, O'Kane PD, et al. Percutaneous Revascularization for Ischemic Left Ventricular Dysfunction. N Engl J Med. 2022;387(15):1351-60. doi:10.1056/NEJMoa2206606.
14. Попова Н.В., Попов В.А., Ревишвили А.Ш. Реваскуляризация миокарда при стабильных формах ишемической болезни сердца: современное состояние проблемы. Кардиология. 2023;63(6):3-13. doi:10.18087/cardio.2023.6.n2263.
15. Петросян К.В., Абросимов А.В., Гончарова Е.С. Физиологическая оценка показателей коронарного кровотока в современной стратегии интервенционного лечения ишемической болезни сердца. Грудная и сердечно-сосудистая хирургия. 2024;3(66):270-81. doi:10.24022/0236-2791-2024-66-3-270-281.
Об авторах
Е З ГолуховаРоссия
Академик РАН, директор
Москва
И Ю Сигаев
Россия
И.о. директора Института Коронарной и Сосудистой хирургии, д.м.н., профессор, зав. отделением хирургии сочетанных заболеваний коронарных и магистральных артерий
Москва
М А Керен
Россия
Д.м.н., с.н.с. отделения хирургии сочетанных заболеваний коронарных и магистральных артерий
Москва
Т В Завалихина
Россия
К.м.н., главный врач Института коронарной и сосудистой хирургии
Москва
К В Петросян
Россия
Д.м.н., руководитель отдела рентгенохирургических методов исследования и лечения сердца и сосудов, врач по рентгенэндоваскулярным методам, диагностики и лечения
Москва
К Б Яхяева
Россия
Врач-кардиолог, м.н.с. научно-консультативного отделения
Москва
И В Волковская
Россия
К.м.н., зав. научноконсультативным отделением
Москва
С А Авакова
Россия
К.м.н., зав. научно-консультативным отделением ИКХ им. В. И. Бураковского
Москва
Дополнительные файлы
- Результаты сравнения коронарного шунтирования (КШ) и чрескожного коронарного вмешательства (ЧКВ) у больных стабильной ишемической болезнью сердца свидетельствуют об их сопоставимой госпитальной и 30-дневной послеоперационной летальности и значительном преимуществе КШ над ЧКВ в отношении снижения отдаленного риска смерти от всех причин, в первую очередь у больных со сложным поражением коронарных артерий (многососудистым и стволовым коронарным поражением) вне зависимости от наличия диабета и больных с не сниженной сократительной способностью миокарда (общей фракцией выброса левого желудочка >40%).
- При однососудистом коронарном поражении отдаленная общая летальность после КШ и ЧКВ не различалась, что при выборе тактики вмешательства свидетельствует в пользу ЧКВ как менее инвазивного метода реваскуляризации.
Рецензия
Для цитирования:
Голухова Е.З., Сигаев И.Ю., Керен М.А., Завалихина Т.В., Петросян К.В., Яхяева К.Б., Волковская И.В., Авакова С.А. Сравнение коронарного шунтирования и стентирования в зависимости от клиникоанатомического сценария по результатам ретроспективного одноцентрового когортного исследования. Российский кардиологический журнал. 2025;30(4):6092. https://doi.org/10.15829/1560-4071-2025-6092. EDN: GAAMJK
For citation:
Golukhova E.Z., Sigaev I.Yu., Keren M.A., Zavalikhina T.V., Petrosyan K.V., Yakhyaeva K.B., Volkovskaya I.V., Avakova S.A. Comparison of coronary artery bypass grafting and stenting depending on the clinical and anatomical scenario: data from the retrospective single-center cohort study. Russian Journal of Cardiology. 2025;30(4):6092. (In Russ.) https://doi.org/10.15829/1560-4071-2025-6092. EDN: GAAMJK

















































