Перейти к:
Место кардиоспленальной оси в развитии фатального исхода инфаркта миокарда
https://doi.org/10.15829/1560-4071-2023-5411
Аннотация
Цель. Сопоставить данные об особенностях макрофагального состава селезенки у пациентов с фатальным инфарктом миокарда (ИМ) и у лиц из контрольной группы без сердечно-сосудистых заболеваний (ССЗ).
Материал и методы. В исследование включены пациенты с фатальным ИМ (n=30); группа контроля (n=5) — лица без ССЗ, погибшие от травм, несовместимых с жизнью. Макрофагальную инфильтрацию забранных во время аутопсии фрагментов селезенки и миокарда оценивали с помощью иммуногистохимического исследования с использованием антител к маркерам макрофагов CD68, CD163, CD206, стабилину-1.
Результаты. Количество исследуемых нами клеток в красной пульпе (КП) у лиц с ИМ: CD163+ 906 (661; 1101), CD68+ 898 (807; 1049), стабилин-1+ 811 (531; 966), CD206+ 11 (9; 19); группа контроля: CD163+ 400 (315; 513), CD68+ 40 (37; 45), стабилин-1+ 186 (107; 206), CD206+ 80 (70; 84). Содержание всех клеток в КП у пациентов с ИМ было высоким и превалировало над их численностью в группе контроля, уступала в количестве только концентрация CD206+ клеток; в контрольной группе преобладали CD163+ клетки (p<0,05). Количество клеток в белой пульпе (БП): CD68+ 312 (260; 348), стабилин-1+ 59 (40; 123), CD163+ 29 (17; 56), CD206+ 2 (1; 5) в группе с ИМ; CD68+ 3 (1; 4), стабилин-1+ 3 (2; 3), CD163+ 23 (1; 48), CD206+ 1 (1; 2) в группе контроля. У лиц с ИМ в БП доминировали CD68+ клетки; в контрольной группе CD163+ (p<0,05). Минимальным и сопоставимым в БП в обеих группах было количество CD206+ клеток (p<0,05), коррелирующее в группе контроля с уровнем стабилин-1+ и CD206+ клеток (r=-0,9, p=0,003) и у пациентов с ИМ — с уровнем CD206+ клеток в миокарде (r=0,6, p=0,004).
Заключение. Выявлено доминирование CD163+ клеток во всех функциональных зонах селезенки в группе контроля и CD68+ клеток у лиц с ИМ. Единственный тип клеток, содержание которого в группе контроля превалировало над таковым у лиц с ИМ в КП и коррелировало в БП со своей концентрацией в миокарде, независимо от групповой принадлежности — CD206+.
Для цитирования:
Керчева М.А., Рябов В.В., Гомбожапова А.Э., Трусов А.А., Степанов И.В., Кжышковска Ю.Г. Место кардиоспленальной оси в развитии фатального исхода инфаркта миокарда. Российский кардиологический журнал. 2023;28(5):5411. https://doi.org/10.15829/1560-4071-2023-5411
For citation:
Kercheva M.A., Ryabov V.V., Gombozhapova A.Е., Trusov A.A., Stepanov I.V., Kzhyshkowska Yu.G. Place of the cardiosplenic axis in the development of fatal myocardial infarction. Russian Journal of Cardiology. 2023;28(5):5411. (In Russ.) https://doi.org/10.15829/1560-4071-2023-5411
Инфаркт миокарда (ИМ) остается одной из ведущих причин смерти во всем мире, несмотря на достигнутые успехи в диагностике и лечении данной патологии [1]. Очевидно, что ИМ не является локальным процессом и не может ограничиваться только ишемическим повреждением и последующей репарацией исключительно в области инфарцированного миокарда [2]. Ряд экспериментальных и клинических данных подтверждает активную вовлеченность системы врожденного иммунитета в развитие и течение постинфарктной воспалительной реакции, при этом задействованными являются кардиоренальная [3], кардиоцеребральная [4] и кардиоспленальная оси [5]. Воспаление является универсальным звеном патогенеза таких ключевых постинфарктных процессов, как повреждение, репарация и последующая регенерация тканей миокарда; макрофаги (мф)/моноциты — ведущие клетки данного процесса [6]. Селезенка является одним из важнейших периферических органов иммуногенеза у человека и служит резервуаром моноцитов, принимающих участие как в процессах иммуногенеза, так и в процессе утилизации эритроцитов, фагоцитозе патогенов [7]. Ранний постинфарктный период характеризуется активным привлечением в зону инфарцированного миокарда нейтрофилов и моноцитов — предшественников мф, из их физиологических депо — костного мозга и селезенки [2]. Своевременное и синхронное поступление воспалительных моноцитов в зону инфаркта обеспечивает адекватную регенерацию миокарда и, напротив, предотвращает развитие затяжной воспалительной реакции [8], лежащей в основе развития неблагоприятного ремоделирования сердца и последующего формирования и прогрессирования постинфарктной сердечной недостаточности. Клинические данные, анализирующие макрофагальный/моноцитарный состав селезенки и его динамику в условиях ишемии миокарда, малочисленны [9]. Нами впервые была определена динамика ряда клеток макрофагального состава селезенки с различными фенотипами, в т.ч. в основных ее функциональных зонах, оценена связь этой динамики с изменениями макрофагальной инфильтрации миокарда и клинико-анамнестическими характеристиками, исходами у пациентов с фатальным ИМ [10]. Однако для понимания являются ли обнаруженные данные и закономерности отражением влияния ишемии на макрофагальный состав селезенки и особенности взаимодействия мф по оси "сердце-селезенка", необходимо сопоставить полученные нами данные с результатами, полученными от лиц без сердечно-сосудистой патологии. В связи с чем перед нами была поставлена следующая цель: сопоставить данные об особенностях макрофагального состава селезенки у пациентов с фатальным ИМ и у лиц из контрольной группы без сердечно-сосудистых заболеваний (ССЗ).
Материал и методы
Клинико-анамнестические характеристики
В наше исследование были включены пациенты с фатальным ИМ I типа (n=30). Средний возраст исследуемых лиц был 74,8±9,8 лет. Критериями исключения являлись ИМ II-V типа, наличие онкологических заболеваний, инфекционных осложнений (сепсис, пневмония), клапанной патологии, требующей хирургического вмешательства. Протокол исследования № 128 от 23 декабря 2014г был одобрен комитетом по биомедицинской этике Научно-исследовательского института кардиологии (г. Томск). В рамках настоящего исследования процесс подписания информированного согласия являлся неосуществимым, однако это не противоречило правилам проведения исследования согласно Хельсинкской декларации ("информированное согласие", пункт 32). Патологоанатомическое вскрытие осуществлялось согласно приказу Министерства здравоохранения Российской Федерации от 6 июня 2013г № 354н "О порядке проведения патологоанатомических вскрытий". Группу контроля составляли 5 человек, погибшие от травм, несовместимых с жизнью, и не имевшие ССЗ (возраст от 18 до 55 лет).
Клинико-анамнестические данные группы с ИМ подробно были предоставлены нами ранее [3]. Обращают на себя внимание следующие факты: наличие циркулярного ИМ в 40% случаев, у половины исследуемой выборки ИМ был повторным. Основной причиной летального исхода служил кардиогенный шок.
В качестве объекта для нашего исследования были взяты фрагменты селезенки (в т.ч. белая (БП) и красная пульпа (КП)) и миокарда (инфарктная зона (ИЗ) у лиц с ИМ, участок миокарда — у лиц из контрольной группы), забранные в течение 24 ч после документирования факта смерти при проведении аутопсии. Забранный материал фиксировали в течение суток в 10% забуференном формалине. Подготовка материала для гистологического исследования проводилась по стандартной методике с использованием автомата для гистологической проводки Thermo Scientific Excelsior AS (Thermo Fisher Scientific, США), затем материал заливался в парафин на модульной системе Tissue-Tek® TEC™ 6 (Sakura, Япония). Результаты исследования получены с использованием оборудования Центра коллективного пользования "Медицинская геномика" Томского национального исследовательского медицинского центра Российской академии наук.
Иммуногистохимическое исследование
Для проведения иммуногистохимического исследования при помощи ротационного механического микротома HM 355S (Thermo Fisher Scientific, США) были подготовлены микротомные срезы миокарда и селезенок: с каждого блока делали по 10 срезов для фрагментов селезенки и по 20 срезов для фрагментов миокарда. Затем материал наносили на стекла с L-полилизиновым покрытием, по два среза на одно стекло. Макрофагальную инфильтрацию селезенки и миокарда оценивали два независимых эксперта с помощью иммуногистохимического исследования, проводимого на автоматическом иммуностейнере (Leica Bond-Max, Германия). Для иммунофенотипирования мф были использованы мышиные моноклональные антитела к общему маркеру макрофагов CD68 (Cell Marque, разведение 1:500), антитела к маркеру М2 макрофагов: антитела к CD163 (Cell Marque, разведение 1:50), мышиные моноклональные антитела к CD206 (Santa Cruz, разведение 1:100), синтезированные в лаборатории Врожденного Иммунитета и Иммунологической Толерантности (Университет Гейдельберга) антитела к стабилину-1 RS1 (разведение 1:1000).
Для визуализации исследованных маркеров применялся набор реагентов для детекции Bond на основе Полимера — Bond Polymer Refine Detection (Великобритания). Иммуногистохимическое окрашивание проводилось по стандартному протоколу [4]. Подсчет клеток в селезенке и миокарде производился в 10 случайных полях зрения (объектив 40х) на микроскопе Axio Imager M2 (Zeiss) в светлом поле.
Описание клинико-анамнестических данных
Обработка полученных данных осуществлялась с использованием статистического пакета STATISTICA 12.0. Нормальность количественных данных проверялась по критерию Шапиро-Уилка. Все количественные показатели, не имевшие нормального распределения, описывались медианой (Ме) и интерквартильным интервалом (Q1; Q3), кроме возраста, описанного в виде среднего значения (М) и стандартного отклонения (SD). Категориальные показатели описывались частотами и процентами. Для сравнения количественных показателей в независимых группах использовался критерий Манна-Уитни. Наличие корреляционных связей между количеством клеток в миокарде и селезенке оценивалось с помощью коэффициента корреляции Спирмена. Значение r (коэффициент ранговой корреляции) от 0,4 до 0,7 показало умеренную корреляцию. Проверка статистических гипотез проводилась по уровню значимости р=0,05.
Исследование выполнено за счет гранта Российского научного фонда № 21-75-00025, https://rscf.ru/project/21-75-00025/.
Результаты
Для понимания особенностей макрофагального состава селезенки и ее функциональных зон нами были проанализированы данные, полученные у пациентов с ИМ, и сопоставлены с подобными данными от контрольной группы (табл. 1).
Обращает на себя внимание тот факт, что в обеих функциональных зонах селезенки, как у лиц с ИМ, так и у лиц из контрольной группы, присутствовали все анализируемые нами клетки. В обеих группах количество всех исследуемых клеток макрофагального ряда в КП превалировало над таковым в БП (p<0,05) (рис. 1).
Однако соотношение данных клеток было различным. Так, в БП у лиц с фатальным ИМ превалировало число CD68+ клеток, у лиц из контрольной группы — CD163+ клеток (p<0,05). Минимальным в БП в обеих группах было количество CD206+ клеток (p<0,05). В КП у пациентов с ИМ отмечено высокое содержание всех исследуемых нами клеток, кроме CD206+; у лиц из контрольной группы преобладали CD163+ клетки, минимальным же было количество CD68+ клеток (рис. 1).
По количеству клеток группы были сопоставимы по уровню CD206+ и CD163+ клеток в БП (табл. 1). В БП у пациентов с ИМ количество CD68+ клеток в сотни раз превышало их содержание в группе контроля; количество стабилин-1+ клеток — в десятки раз превышало таковое в группе контроля (табл. 1). В КП у пациентов с ИМ количество CD163+, CD68+ и стабилин-1+ клеток было большим, чем в контрольной группе, однако содержание CD206+ клеток, напротив, было значимо ниже, чем у лиц из контрольной группы (табл. 1).
Относительно корреляций между количеством клеток в миокарде и в селезенке: в контрольной группе была выявлена корреляция между количеством CD206+ клеток в БП и уровнем стабилин-1+ и CD206+ клеток в миокарде (r=-0,9, p=0,003). У пациентов с ИМ выявлена также корреляция с уровнем между количеством CD206+ клеток в БП и уровнем CD206+ клеток в миокарде, однако данная корреляция имела противоположную направленность (r=0,6, p=0,004).
Таблица 1
Особенности макрофагальной инфильтрации селезенки и миокарда у лиц с фатальным ИМ и у лиц из контрольной группы
|
Параметры (клетки) |
Пациенты с ИМ (n=30) Me (25; 75%) |
Контрольная группа (n=5) Me (25; 75%) |
р |
|
CD68+ (селезенка БП) |
312 (260; 348) |
3 (1; 4) |
0,00003 |
|
Стабилин-1+ (селезенка БП) |
59 (40; 123) |
3 (2; 3) |
0,00004 |
|
CD163+ (селезенка БП) |
29 (17; 56) |
23 (1; 48) |
0,5 |
|
CD206+ (селезенка БП) |
2 (1; 5) |
1 (1; 2) |
0,2 |
|
CD163+ (селезенка КП) |
906 (661; 1101) |
400 (315; 513) |
0,0002 |
|
CD68+ (селезенка КП) |
898 (807; 1049) |
40 (37; 45) |
0,00003 |
|
Стабилин-1+ (селезенка КП) |
811 (531; 966) |
186 (107; 206) |
0,00003 |
|
CD206+ (селезенка КП) |
11 (9; 19) |
80 (70; 84) |
0,00003 |
|
CD163+ (миокард) |
460 (62; 846) |
26 (20; 36) |
<0,00001 |
|
CD68+ (миокард) |
106 (56; 376) |
17 (13; 24) |
<0,0001 |
|
CD206+ (миокард) |
31 (12; 106) |
21 (17; 31) |
0,07 |
|
Стабилин-1+ (миокард) |
1,5 (0; 102) |
13 (8; 30) |
0,4 |
Примечание: р — уровень статистической значимости отличия между исследуемой группой с фатальным ИМ и контрольной группой.
Сокращения: БП — белая пульпа, ИМ — инфаркт миокарда, КП — красная пульпа.
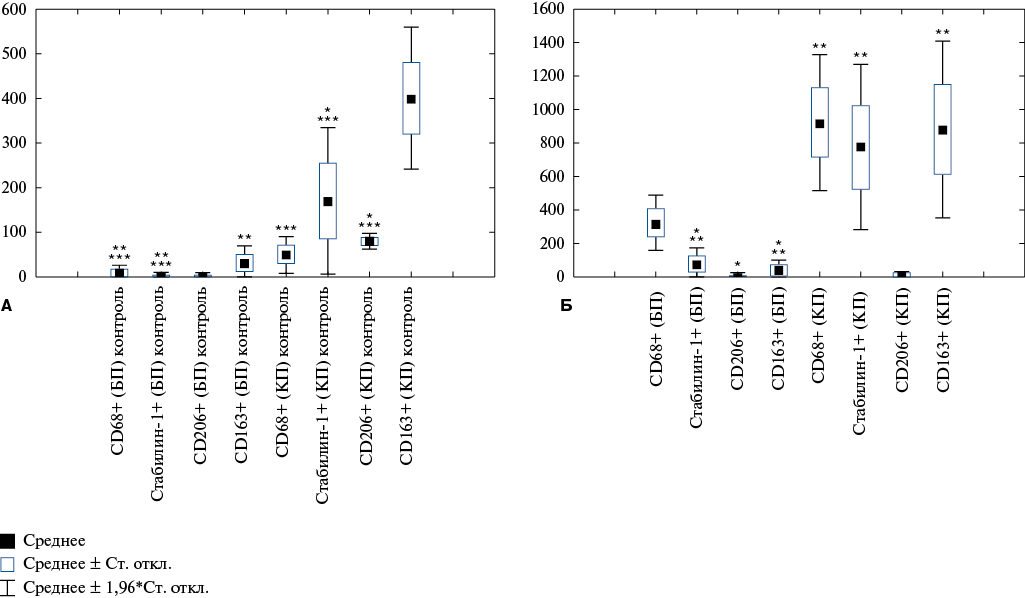
Рис. 1. Соотношение клеток макрофагального ряда в КП и БП селезенки А) у лиц из контрольной группы и Б) у лиц с ИМ.
Примечание: * — статистически значимые различия относительно количества CD68+ клеток в исследуемой зоне в конкретной группе, ** — относительно количества CD206+ клеток, *** — относительно количества CD163+ клеток.
Сокращения: БП — белая пульпа, КП — красная пульпа.
Обсуждение
Обнаруженное нами разнообразие клеточного, а именно, макрофагального состава селезенки, как у лиц с ИМ, так и у лиц из контрольной группы отражает тот факт, что селезенка является одним из важнейших периферических органов иммуногенеза у человека [11]. Выявленные различия в клеточном составе селезенки у пациентов с ИМ и у лиц из контрольной группы, а именно, значимое превалирование определенных типов мф — воспалительных CD68+ мф в КП и БП, и, напротив сниженное количество клеток с иным, противовоспалительным фенотипом, таких как CD206+ в КП, наряду с их низким содержанием в БП у лиц с ИМ, подтверждают вовлеченность селезенки в процессы постинфарктного воспаления и регенерации миокарда. Известно, что макрофагальный состав селезенки представлен широким спектром клеток, фенотип которых способен меняться в зависимости от физиологических условий и их окружения [5]. Ранее было выявлено, что в условиях ишемии миокарда в экспериментах на животных селезенка выполняет роль одного из главных физиологических депо моноцитов, своевременная и синхронная миграция которых в ткани миокарда наряду с согласованной активностью этих клеток в самом миокарде обеспечивает адекватную регенерацию миокарда и предотвращает неадекватную затяжную воспалительную реакцию, имеющую неблагоприятный прогноз в экспериментальных и клинических условиях [5][12].
Известно, что структуру селезенки составляют две ключевые зоны, отличные как по своему составу, так и по реализуемым функциям — КП и БП, между которыми пролегает маргинальная зона [7]. КП селезенки составляет до 70% от массы органа и ответственна за процессы поддержания гомеостаза крови за счет активного разрушения поврежденных и стареющих эритроцитов и их последующего фагоцитоза [13]. БП селезенки состоит из лимфоидных фолликулов со светлыми центрами и периартериальных лимфоидных муфт и отражает активность процессов иммуногенеза, инициируемых антигенами в органах [13]. Согласно результатам нашего исследования, содержание всех исследуемых нами типов клеток преобладало в КП над их количеством в БП, вне зависимости от принадлежности лиц к группам. Это, вероятно, подтверждает тот факт, что ведущая функция КП — фильтрационная [7]. Наличие выявленных взаимосвязей между высоким уровнем CD206+ клеток в БП у лиц с ИМ и их высокой концентрацией в ИЗ миокарда, и противоположная направленность данной корреляции у лиц без ССЗ косвенно может подтверждать участие БП в процессах иммуногенеза [5].
Интересным представляется тот факт, что в КП и БП отмечается преобладание одного и того же фенотипа клеток и у лиц с ИМ и у лиц из контрольной группы, однако фенотипы доминирующих клеток были различны. В группе контроля в КП и БП доминировали CD163+ клетки, принимающие активное участие в фагоцитозе старых эритроцитов и продуктов метаболизма железа [7]. Их преобладание в КП у лиц без ССЗ и с фатальным исходом может служить отражением посмертных изменений в организме [14]. Тот факт, что содержание CD163+ клеток в БП является сопоставимым между группами, равно как и стабилин-1+ клеток, может указывать, что данные типы клеток реагируют на процесс ишемии повышенным генезом, т.к. выработка остальных типов клеток снижена в БП в разы при ИМ. Кроме того, подобные данные о преобладании CD163+ клеток в КП были получены ранее и могут характеризовать данный пул клеток как наиболее распространённый в организме [15]. У лиц же с ИМ отмечено преобладание CD68+ клеток, как в КП, так и в БП СВ68+, что, вероятно, обусловлено воспалительной природой этого типа клеток [3, 4], и, вероятно, их высокая концентрация в селезенке у лиц с ИМ отражает затянувшийся воспалительный ответ в нашей выборке, связанный с развитием осложнений ИМ и его неблагоприятного исхода. Возможно, именно эти клетки способны мигрировать в очаг воспаления в миокарде, покидая, в свою очередь, селезенку и поддерживая затяжной воспалительный ответ, что подтверждается тем фактом, что в эксперименте — CD68+ антигены могут экспрессироваться как на поверхности мф, так и на поверхности моноцитов [4, 7]. О содержании стабилин-1+ клеток в селезенке у лиц с ИМ и их динамике в зависимости от сроков ранее известно не было, как и не было сопоставления этих данных с результатами, полученными у лиц без ССЗ. Обширные гистологические исследования показали, что стабилин-1 экспрессируется тканевыми мф и синусоидальными эндотелиальными клетками в здоровом организме; его экспрессия как на мф, так и на различных подтипах эндотелиальных клеток индуцируется во время хронического воспаления и онкогенеза [4]. Возможно, сохраняющееся пролонгированное воспаление, обусловливающее неблагоприятный исход у пациентов с ИМ, характеризует высокое содержание стабилин-1+ клеток в КП. У лиц без ССЗ содержание данного типа клеток в КП было значимо меньшим, чем у лиц с ИМ. Данный тип клеток принадлежит к мф М2 типа, ранее было выявлено наличие их высокой концентрации в ИЗ миокарда у лиц с фатальным ИМ [4], таким образом, возможно их высокое содержание как в КП, так и в БП отражает адекватный ответ организма на ишемию и участие данного типа клеток в формировании регенераторной фазы. Что также подтверждается и тем фактом, что сниженное содержание мф М2 типа — CD206+ клеток в миокарде характеризуется и низким содержанием стабилин-1 клеток в БП селезенки в группе контроля, отражая то, что данный тип клеток может генерироваться "согласно потребностям" организма.
Интересен факт, что количество CD206+ клеток в БП как в группе контроля, так и у лиц с ИМ было минимальным и сопоставимым друг с другом. Однако возможно, что для лиц без ССЗ сниженный генез данного фенотипа клеток служит вариантом физиологической нормы, и, напротив, у лиц с ИМ недостаточный генез данного типа клеток с противовоспалительной активностью может обусловливать неблагоприятный исход, что подтверждают ранее полученные экспериментальные данные о полезной роли репаративных мф на ранней стадии воспаления и связи дефицита CD206+ в миокарде с фатальным исходом [12]. Низкое содержание данного фенотипа клеток при ИМ в КП наряду с их низким содержанием в БП может отражать истощение данного типа клеток или их недостаточную выработку, что может обусловливать неблагоприятный исход [3][10]. Однако, согласно полученным ранее данным, не складывается однозначного впечатления о благоприятном или, напротив, негативном влиянии пониженного/повышенного содержания CD206+ клеток на процессы регенерации миокарда и клинические исходы в условиях острой ишемии миокарда [3][12][16]. Так, Guiteras R, et al. (2016) сообщали ранее, что увеличение числа CD206+ клеток в почках наряду с известными маркерами неблагоприятного прогноза у больных, перенесших ИМ, ассоциируется с ранним и фатальным исходом [16]. Нами же было определено, что пониженное содержание CD206+ клеток в почках наряду с их высоким содержанием в миокарде характеризует неблагоприятный исход ИМ [3]. Интересен и тот факт, что низкое содержание СD206+ клеток в БП при ИМ ассоциировалось с их невысокой концентрацией в миокарде, что косвенно может указывать на тот факт, что неадекватный иммуногенез и низкая производительность мф М2 типа на фоне их истощения у пациентов с ИМ связана с неблагоприятным прогнозом. Вероятно, последующая оценка пороговых значений концентрации CD206+ клеток в миокарде на большей выборке могла бы внести определенную ясность в понимании места данного типа клеток в процессе постинфарктной регенерации миокарда. Все вышеуказанные данные получены нами впервые, т.к. ранее комплексное сопоставление количественного содержания спектра мф, включающих как мф М1, так и М2 типа, не проводилось ни в эксперименте, ни в клинике; не сравнивалось их содержание между лицами с ИМ и контрольной группой. Существующие ранее экспериментальные данные оценивали содержание либо одного из фенотипов мф в эксперименте [5], либо содержание предшественников мф — моноцитов [10].
Наше исследование имело ряд ограничений, обусловленных тем, что наша выборка была ограничена по объему; оценивали только данные, полученные у лиц с фатальным исходом, не сопоставляя их с данными, полученными у выживших лиц с ИМ. Последующее сопоставление наших результатов с результатами, полученными от пациентов с благополучно разрешившимся ИМ, позволит понять являются ли данные изменения характерными именно для лиц с фатальным ИМ. Полученные нами данные могут лечь в основу разработки новых персонализированных подходов к противовоспалительному лечению осложнений ИМ. Для эффективного воздействия на моноциты и мф при ИМ, вероятно, потребуется найти правильный баланс между двумя его фазами: рекрутированием моноцитов и удалением дебриса провоспалительными мф на первых стадиях и рекрутированием моноцитов и репаративными мф, способствующими заживлению миокарда на более поздних стадиях.
Заключение
При сопоставлении макрофагального состава селезенки лиц с фатальным ИМ и лиц без ССЗ выявлено преобладание различных типов клеток: у лиц без ССЗ во всех функциональных зонах селезенки преобладали CD163+ клетки, у лиц с ИМ — CD68+ клетки в БП и CD68+, CD163+, стабилин-1+ клетки в КП, содержание которых в разы превышало их концентрацию в КП у лиц без ССЗ. В БП у лиц с ИМ отмечалась высокая концентрация CD68+ и стабилин-1+ клеток, низким и сопоставимым с группой контроля было содержание CD206+ и 163+ клеток.
Единственный тип клеток, содержание которого превышало таковое у лиц без ССЗ в КП — CD206+ клетки; именно содержание клеток данного типа в БП ассоциировалось с их концентрацией в миокарде, как у лиц с ИМ, так и у лиц без ССЗ, характер корреляций был разнонаправленным.
Отношения и деятельность. Исследование выполнено за счет гранта Российского научного фонда № 21-75-00025, https://rscf.ru/project/21-75-00025/.
Список литературы
1. Collet JP, Thiele H, Barbato E, et al. 2020 ESC Guidelines for the management of acute coronary syndromes in patients presenting without persistent ST-segment elevation. Eur Heart J. 2021;42(14):1289-367. doi:10.1093/eurheartj/ehaa575.
2. Рябов В. В., Гомбожапова А. Э., Роговская Ю. В. и др. Воспаление как универсальное патогенетическое звено повреждения, репарации и регенерации при остром коронарном синдроме. От эксперимента к клинике. Кардиология. 2019;59(8S):15-23. doi:10.18087/cardio.2668.
3. Kercheva M, Ryabov V, Gombozhapova A, et al. Macrophages of the "Heart-Kidney" Axis: Their Dynamics and Correlations with Clinical Data and Outcomes in Patients with Myocardial Infarction. Journal of Personalized Medicine. 2022;12(2):127. doi:10.3390/jpm12020127.
4. Ребенкова М. С., Гомбожапова А. Э., Роговская Ю. В. и др. Динамика CD68+ и stabilin-1+ макрофагальной инфильтрации в головном мозге у пациентов с инфарктом миокарда. Кардиология. 2019;59(4S):44-50. doi:10.18087/cardio.2584.
5. Heusch G. The Spleen in Myocardial Infarction. Circ. Res. 2019;124:26-8. doi:10.1161/CIRCRESAHA.118.314331.
6. Prabhu S, Frangogiannis N. The Biological Basis for Cardiac Repair After Myocardial Infarction: From Inflammation to Fibrosis. Circ. Res. 2016;119:91-112. doi:10.1161/CIRCRESAHA.116.303577.
7. Андрюхова Е. С., Таширева Л. А., Вторушин С. В. и др. Макрофаги селезенки: особенности популяционного состава и функции. Цитология. 2021;64(1):14-25. doi:10.31857/S0041377122010023.
8. Steffens S, Van Linthout S, Sluijter J, et al. Stimulating pro-reparative immune responses to prevent adverse cardiac remodelling: Consensus document from the joint 2019 meeting of the ESC Working Groups of cellular biology of the heart and myocardial function. Cardiovasc. Res. 2020;116:1850-62. doi:10.1093/cvr/cvaa137.
9. Van der Laan A, Ter Horst E, Delewi R, et al. Monocyte subset accumulation in the human heart following acute myocardial infarction and the role of the spleen as monocyte reservoir. Eur. Heart J. 2014;35:376-85. doi:10.1093/eurheartj/eht331.
10. Kercheva M, Ryabov V, Trusov A, et al. Characteristics of the Cardiosplenic Axis in Patients with Fatal Myocardial Infarction. Life. 2022;12(5):673. doi:10.3390/life12050673.
11. Чулкова С. В., Стилиди И. С., Глухов Е. В. и др. Селезенка периферический орган иммунной системы. Влияние спленэктомии на иммунный статус. Вестн. РОНЦ им. Н. Н. Блохина РАМН. 2014;1-2(94):21-4.
12. Peet C, Ivetic A, Bromage D, et al. Cardiac monocytes and macrophages after myocardial infarction. Cardiovasc. Res. 2020;116:1101-12. doi:10.1093/cvr/cvz336.
13. Crane G, Liu Y, Chadburn A. Spleen: Development, anatomy and reactive lymphoid pro¬liferations. Semin Diagn Pathol. 2021;38(2):112-24. doi:10.1053/j.semdp.2020.06.003.
14. Ioan B, Alexa T, Alexa ID. Do we still need the autopsy? Clinical diagnosis versus autopsy diagnosis. Rom J Leg Med. 2012;20:307-12. doi:10.4323/rjlm.2012.307.
15. Kristiansen M, Graversen J, Jacobsen C, et al. Identification of the haemoglobin scavenger receptor. Nature. 2001;409(6817):198-201. doi:10.1038/35051594.
16. Guiteras R, Flaquer M, Cruzado J, et al. Macrophage in chronic kidney disease. Clin. Kidney J. 2016;9:765-71. doi:10.1093/ckj/sfw096.
Об авторах
М. А. КерчеваРоссия
Керчева Мария Анатольевна — кандидат медицинских наук, научный сотрудник отделения неотложной кардиологии, научный сотрудник лаборатории трансляционной медицины
Томск
Конфликт интересов:
Конфликт интересов не заявлен.
В. В. Рябов
Россия
Рябов Вячеслав Валерьевич — доктор медицинских наук, исполняющий обязанности заведующего отделением неотложной кардиологии, ведущий научный сотрудник лаборатории трансляционной клеточной и молекулярной биомедицины, заведующий кафедрой кардиологии
Томск
Конфликт интересов:
Конфликт интересов не заявлен.
А. Э. Гомбожапова
Россия
Гомбожапова Александра Энхэевна — кандидат медицинских наук, научный сотрудник отделения неотложной кардиологии, ассистент кафедры кардиологии
Томск
Конфликт интересов:
Конфликт интересов не заявлен.
А. А. Трусов
Россия
Трусов Андрей Андреевич — аспирант отделения неотложной кардиологии
Томск
Конфликт интересов:
Конфликт интересов не заявлен.
И. В. Степанов
Россия
Степанов Иван Вадимович — кандидат медицинских наук, заведующий патологоанатомическим отделением
Томск
Конфликт интересов:
Конфликт интересов не заявлен.
Ю. Г. Кжышковска
Германия
Кжышковска Юлия Георгиевна — доктор медицинских наук, заведующий лабораторией трансляционной клеточной и молекулярной биомедицины, зав. отделом врожденного иммунитета и иммунологической толерантности Института иммунологии и трансфузионной медицины, медицинский факультет Маннгейма, Университет Гейдельберга
Томск, Гейдельберг, Германия
Конфликт интересов:
Конфликт интересов не заявлен.
Дополнительные файлы
Рецензия
Для цитирования:
Керчева М.А., Рябов В.В., Гомбожапова А.Э., Трусов А.А., Степанов И.В., Кжышковска Ю.Г. Место кардиоспленальной оси в развитии фатального исхода инфаркта миокарда. Российский кардиологический журнал. 2023;28(5):5411. https://doi.org/10.15829/1560-4071-2023-5411
For citation:
Kercheva M.A., Ryabov V.V., Gombozhapova A.Е., Trusov A.A., Stepanov I.V., Kzhyshkowska Yu.G. Place of the cardiosplenic axis in the development of fatal myocardial infarction. Russian Journal of Cardiology. 2023;28(5):5411. (In Russ.) https://doi.org/10.15829/1560-4071-2023-5411
JATS XML

















































