Перейти к:
Возможности управления риском развития сердечной недостаточности у больных с ожирением
https://doi.org/10.15829/1560-4071-2023-5363
Аннотация
В ряде исследований проводилась оценка риска развития диастолической дисфункции (ДД) левого желудочка (ЛЖ) у пациентов с ожирением. Однако исследований, где бы проводился анализ пациентов, у которых не развилась ДД ЛЖ, крайне мало.
Цель. Изучить факторы, предупреждающие развитие ДД ЛЖ у больных с ожирением.
Материал и методы. В исследование был включен 101 мужчина с ожирением, исходно не имевшие ДД ЛЖ. Через 4,7±0,3 лет повторно проводилась оценка антропометрических показателей (индекс массы тела (ИМТ), окружность бедер, окружность талии (ОТ)) и диастолической функции ЛЖ. Всем пациентам на момент включения в исследование определялся уровень нейрогуморальных (лептин, адипонектин, рецептор к лептину), провоспалительных (фактор некроза опухоли-α, интерлейкин-6, -10, С-реактивный белок) и профибротических факторов (коллаген I и III типа, матричная металлопротеиназа-3, васкулоэндотелиальный фактор роста, трансформирующий фактор роста β).
Результаты. За 4,7±0,3 лет наблюдения у 26,7% от общего количества включенных в исследование зарегистрировано снижение массы тела. Выявлена тенденция к уменьшению показателя толщины эпикардиального жира (тЭЖТ) на 0,5 мм (7,49 (6,00; 9,00) мм на момент включения и в динамике 7,04 (6,00; 9,00) мм (р=0,13)). По результатам эхокардиографии у 20 пациентов (19,8%) через 4,7±0,3 лет выявлена ДД ЛЖ. При сравнительном анализе исходных антропометрических показателей тЭЖТ и в динамике через 4,7±0,3 лет в группах пациентов, у которых развилась ДД ЛЖ (ДД+) и у которых ДД ЛЖ не развилась (ДД-) выявлено статистически значимое уменьшение массы тела (р=0,03), ИМТ (р=0,02), ОТ (р=0,04) и тЭЖТ (р=0,002) только в группе ДД-. У пациентов, у которых впоследствии развилась ДД ЛЖ, исходно наблюдалось повышение уровня фактора некроза опухоли-α (р=0,02), интерлейкина-6 (р=0,01), свободных жирных кислот (р=0,001), коллагена I (р=0,001), коллагена III типа (р=0,02) и снижение уровня адипонектина (р=0,001).
Заключение. Таким образом, у пациентов, у которых уменьшились вес, ИМТ, ОТ и тЭЖТ за период наблюдения в течение 4,7±0,3 лет, ДД ЛЖ не развивалась, что связано со снижением риска развития липотоксического поражения миокарда на фоне эпикардиального ожирения.
Ключевые слова
Для цитирования:
Гриценко О.В., Чумакова Г.А., Груздева О.В., Субботин Е.А. Возможности управления риском развития сердечной недостаточности у больных с ожирением. Российский кардиологический журнал. 2023;28(4):5363. https://doi.org/10.15829/1560-4071-2023-5363
For citation:
Gritsenko O.V., Chumakova G.A., Gruzdeva O.V., Subbotin E.A. Possibilities for managing the left ventricular diastolic dysfunction risk in obese patients. Russian Journal of Cardiology. 2023;28(4):5363. (In Russ.) https://doi.org/10.15829/1560-4071-2023-5363
В многочисленных исследованиях было показано, что ожирение является фактором риска (ФР) развития сердечной недостаточности (СН). Так, в исследовании Framingham Heart Study, включившем 5881 участника, заболеваемость СН увеличивалась на 5% у мужчин и на 7% у женщин на каждую единицу увеличения индекса массы тела (ИМТ) после поправки на другие ФР [1][2]. Впоследствии это было подтверждено и в других крупных проспективных эпидемиологических исследованиях [3]. В связи с этим в опубликованном в 2022г руководстве по лечению СН AHA/ACC/HFSA ожирение указано в числе основных ФР развития СН [4].
В настоящее время распространенность ожирения приняла масштабы глобальной эпидемии [2]. Безусловно, распространение в популяции такого ФР, как ожирение, не может не сказываться на распространении СН с сохраненной фракцией выброса (ФВ). При этом особую роль в развитии ассоциированных с ожирением заболеваний играет висцеральное ожирение [5]. Одним из главных механизмов формирования дисфункции миокарда при ожирении является липотоксическое поражение кардиомиоцитов с последующим развитием фиброза миокарда, который считается ведущей морфологической основой развития диастолической дисфункции (ДД) левого желудочка (ЛЖ), являющейся главным патогенетическим механизмом развития СН с сохраненной ФВ [6]. Так, в исследовании, включившем 108 нормотензивных пациентов без клинических признаков сердечно-сосудистых заболеваний, было показано наличие ассоциации эпикардиального ожирения (ЭО), определяемого на основании эхокардиографической оценки толщины эпикардиальной жировой ткани (тЭЖТ), с параметрами, характеризующими структурно-функциональное ремоделирование сердца. При этом пациенты с ЭО отличались увеличением индексированных показателей массы миокарда ЛЖ и объема левого предсердия, более высокой частотой гипертрофии и ДД ЛЖ, что, наиболее вероятно, лежит в основе развития в последующем СН [7].
В настоящее время крайне актуальным является изучение влияние ожирения, в т.ч. висцерального, на риск развития СН. Ранее нами было проведено исследование, в котором изучалась роль профибротических, метаболических и нейрогуморальных факторов в развитии ДД ЛЖ у пациентов с ожирением. По его результатам была выявлена совокупность предикторов, позволяющая спрогнозировать развитие ДД ЛЖ с процентом верного предсказания 95,3%. Помимо тЭЖТ, в перечень предикторов вошли такие показатели, как глюкоза, холестерин липопротеинов низкой плотности, триглицериды, рецептор к лептину, лептин, матриксная металлопротеиназа 3 типа, свободные жирные кислоты (СЖК), С-концевой пропептид проколлагена I типа [8]. В этом исследовании не проводился анализ группы пациентов, у которых не развилась ДД ЛЖ.
В связи с этим целью данного исследования стало изучение факторов, предупреждающих развитие ДД ЛЖ у больных с ожирением.
Материал и методы
В 2016-2017гг в результате предварительного скрининга в исследование были включены мужчины (n=101), которые обращались к кардиологу с неспецифическими болями в грудной клетке. Исследование проведено в соответствии с требованиями Хельсинкской декларации и стандартами надлежащей клинической практики (Good Clinical Practice). Перед включением в исследование всеми пациентами было подписано информированное согласие. Средний возраст пациентов составил 54,3±8,2 года.
Обязательным критерием включения пациентов в исследование было наличие общего ожирения (ИМТ ≥30 кг/м2).
Критериями исключения пациентов из исследования было наличие артериальной гипертензии, в т.ч. маскированных форм, атеросклеротического поражения коронарных артерий, сахарного диабета, ДД ЛЖ. С целью исключения сердечно-сосудистых заболеваний пациентам проводились следующие исследования: для исключения коронарной болезни сердца — мультиспиральная компьютерная томография коронарных артерий (64-срезовый томограф фирмы Toshiba, Япония, обработка данных на рабочей станции VITREA) или коронароангиография (Integris 3000, Philips, Голландия); для исключения артериальной гипертензии — суточное мониторирование артериального давления (МД-01М, Россия).
Эхокардиография (ЭхоКГ) проводилась секторным фазированным датчиком М5Sс 1,5-4,5 МГц на ультразвуковой системе VIVID Е95 (GE, Healthcare, США). Для оценки ДД ЛЖ у пациентов с сохраненной ФВ ЛЖ использовали критерии Американского эхокардиографического общества и Европейской эхокардиографической ассоциации 2016г, проводилось определение следующих показателей: в импульсно-волновом режиме тканевого допплера регистрировали диастолическую скорость смещения латеральной и медиальной (перегородочной) части фиброзного кольца митрального клапана (е’, м/с), скорость пика раннего диастолического наполнения ЛЖ в режиме импульсно-волнового допплера (пик Е трансмитрального потока, м/с), отношение Е/е’, индекс объема левого предсердия (мл/м2), максимальную скорость регургитации на трикуспидальном клапане (м/с) [9].
Для визуализации и измерения линейной тЭЖТ использовалось ЭхоКГ-исследование. Измерение проводилось из стандартной парастернальной позиции по длинной оси ЛЖ (визуализировалось эхонегативное пространство между внешней стенкой миокарда и висцеральным слоем перикарда) [10].
С целью повторной оценки диастолической функции ЛЖ в 2021г проводилось ЭхоКГ-исследование. Среднее время наблюдения составило 4,7±0,3 лет. По результатам проведенного обследования через 4,7±0,3 лет у 8 пациентов выявлены критерии исключения (ДД ЛЖ, сахарный диабет, артериальная гипертензия). В последующем из анализа данные пациенты были исключены. Повторно измерялась тЭЖТ и проводилось антропометрическое исследование с определением окружности талии (ОТ), окружности бедер (ОБ), веса, роста, ИМТ (всем пациентам при консультировании были даны рекомендации по немедикаментозной терапии ожирения — изменение образа жизни посредством коррекции питания и расширения объема физических нагрузок).
Всем пациентам с помощью иммуноферментного анализа проводилось определение уровней профибротических факторов: коллагена I и III типов (Cloud-Clone Corp., США), С-концевого пропептида проколлагена I типа (PICP) (Cloud-Clone Corp., США), матриксной металлопротеиназы-3 (ebioscience, Австрия), трансформирующего фактора роста-β (TGF-β) (ebioscience, Австрия), васкулоэндотелиального фактора роста (VEGFA) (ebioscience, Австрия). Также с помощью иммуноферментного анализа проводилось определение уровней провоспалительных цитокинов и адипокинов: фактора некроза опухоли-α (ФНО-α) (ebioscience, Австрия), интерлейкина (ИЛ)-6, ИЛ-10 (ebioscience, Австрия), С-реактивного белка (Monobind, США), адипонектина и рецептора к лептину (BioVendor, Чехия), лептина (Diagnostics Biochem Canada Inc, Канада). Уровень СЖК определялся с использованием тест-систем Thermo Fisher Sientific (Германия).
Статистический анализ полученных данных проводили с использованием программ SAS 9.3, STATISTICA 13 и SPSS-26. Полученные данные в тексте представлены в виде М±SD, где М — среднее значение, SD — стандартное отклонение и Me (Q25-Q75), где Мед — медиана, НКв и ВКв — нижний и верхний квартили, соответственно. Проверка нормальности распределения количественных признаков в отдельных группах сравнения проводилась с использованием критериев Колмогорова-Смирнова, Шапиро-Уилка, Крамера-фон-Мизеса и Андерсона-Дарлинга. Проверка статистических гипотез проводилась при уровне значимости р, равном 0,05.
Результаты
На момент включения в исследование средний вес пациентов составил 95,68 (88,0; 101,0) кг, а в динамике — 92,07 (86,0; 99,0) кг (р=0,02). Также статистически значимо отличался ИМТ на момент включения и через 4,7±0,3 лет: 33,7 (31,23; 35,26) кг/м2 и 32,59 (30,79; 34,26) кг/м2, соответственно (р=0,004). Через 4,7±0,3 лет снижение веса было выявлено у 27 пациентов, что соответствует 26,7% от общего числа включенных в исследование. По таким показателям, как ОТ, ОБ и рост, статистически значимых отличий не выявлено. Динамика антропометрических показателей у пациентов с ожирением представлена в таблице 1.
Таблица 1
Сравнительная характеристика антропометрических показателей у пациентов с ожирением на момент включения и через 4,7±0,3 лет наблюдения
|
Группа Показатель |
На момент включения, n=101 |
Через 4,7±0,3 лет наблюдения, n=93 |
р-уровень |
|
Вес, кг, Мед (НКв; ВКв) |
95,68 (88,0; 101,0) |
92,07 (86,0; 99,0) |
0,02 |
|
Рост, см, Мед (НКв; ВКв) |
1,68 (1,63; 1,74) |
1,68 (1,62; 1,75) |
0,96 |
|
ИМТ, кг/м2, Мед (НКв; ВКв) |
33,7 (31,23; 35,26) |
32,59 (30,79; 34,26) |
0,004 |
|
ОТ, см, Мед (НКв; ВКв) |
105,81 (99,0; 113,0) |
103,79 (98,0; 110,0) |
0,11 |
|
ОБ, см, Мед (НКв; ВКв) |
110,73 (105,0; 115,0) |
108,48 (102,0; 114,0) |
0,06 |
Сокращения: ИМТ — индекс массы тела, ОБ — окружность бедер, ОТ — окружность талии.
При сравнительном анализе величины тЭЖТ выявлено, что на момент включения у пациентов с ожирением (n=101) она составила 7,49 (6,00; 9,00) мм. При проведении повторного измерения через 4,7±0,3 лет (n=93) выявлено, что показатель тЭЖТ равен 7,04 (6,00; 9,00) мм (р=0,13), рисунок 1.
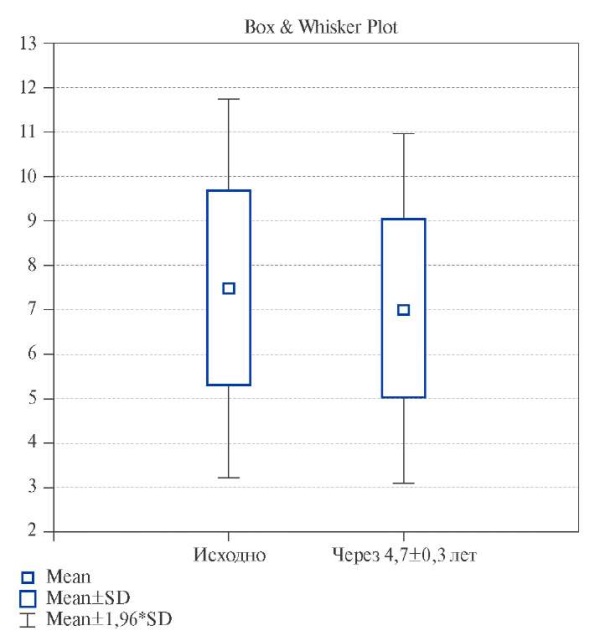
Рис. 1. Величина тЭЖТ у пациентов с ожирением на момент включения в исследование и через 4,7±0,3 лет.
Выявлено, что у 20 пациентов (19,8%) имеется нарушение диастолической функции ЛЖ. У некоторых пациентов появились ЭхоКГ-признаки ДД ЛЖ в различных комбинациях, у всех пациентов определялась 1 степень ДД ЛЖ.
В зависимости от исходной степени выраженности ЭО, которое определялось по тЭЖТ, измеренной с помощью ЭхоКГ, было выделено две группы: ЭО+ (n=70), ЭО- (n=31). При определении ЭО пороговое значение тЭЖТ принималось равным ≥7 мм, ранее показавшее связь с риском развития метаболических нарушений [11]. Через 4,7±0,3 лет было выявлено, что ДД ЛЖ развилась у 18 (90%) пациентов в группе с ЭО, у 2 пациентов — в группе без ЭО, что составило 10% от числа пациентов с выявленной ДД ЛЖ [8]. Таким образом, ДД ЛЖ чаще развивалась у пациентов, имеющих ЭО. Однако, как видно из таблицы 2, спустя 4,7±0,3 лет у пациентов с ожирением наблюдалось только статистически значимое увеличение индекса объема левого предсердия до 35,04 мл/м2 (р=0,0003), по таким показателям, как e’, E/e’, максимальная скорость трикуспидальной регургитации, статистически значимых отличий выявлено не было.
Таблица 2
Сравнительная характеристика ЭхоКГ показателей ДД ЛЖ у пациентов с ожирением на момент включения и через 4,7±0,3 лет наблюдения
|
Группа Показатель |
На момент включения, n=101 |
Через 4,7±0,3 лет наблюдения, n=93 |
р-уровень |
|
Е, м/с, Мед (НКв; ВКв) |
0,89 (0,82; 0,99) |
0,89 (0,84; 0,98) |
0,89 |
|
e’, см/с, Мед (НКв; ВКв) |
0,09 (0,09; 0,11) |
0,09 (0,08; 0,11) |
0,16 |
|
E/e’ср, усл. ед., Мед (НКв; ВКв) |
9,19 (8,18; 10,75) |
10,62 (8,11; 11,13) |
0,13 |
|
Индекс объема левого предсердия, мл/м2, Мед (НКв; ВКв) |
28,43 (24,85; 31,02) |
31,64 (28,95; 35,00) |
<0,001 |
|
Максимальная скорость трикуспидальной регургитации, м/с, Мед (НКв; ВКв) |
2,73 (2,54; 2,89) |
2,63 (2,30; 2,98) |
0,06 |
Сокращения: Е — скорость раннего диастолического наполнения левого желудочка, e’ — скорость смещения латеральной и медиальной части фиброзного кольца митрального клапана, E/e’ — отношение скорости раннего наполнения левого желудочка к средней скорости движения латеральной и медиальной части фиброзного кольца митрального клапана.
При сравнительном анализе антропометрических показателей, а также показателя ЭО (тЭЖТ), исходно и в динамике через 4,7±0,3 лет в группах пациентов, у которых развилась ДД ЛЖ (ДД+) и у которых ДД ЛЖ не развилась (ДД-) выявлено, что статистически значимое уменьшение веса (р=0,03), ИМТ (р=0,02), ОТ (р=0,04) и тЭЖТ (р=0,002) в группе ДД-, тогда как в группе ДД+ статистически значимых различий между изучаемыми параметрами выявлено не было. Результаты представлены в таблице 3.
Таблица 3
Сравнительная оценка антропометрических показателей и тЭЖТ в группах ДД+ и ДД- на момент включения в исследование и через 4,7±0,3 лет
|
Группа Показатель |
ДД+, n=20 |
р-уровень |
ДД-, n=73 |
р-уровень |
||
|
На момент включения |
Через 4,7±0,3 лет |
На момент включения |
Через 4,7±0,3 лет |
|||
|
тЭЖТ, мм, Мед (НКв; ВКв) |
9,25 (9,0; 10,0) |
8,70 (8,0; 9,00) |
0,11 |
7,29 (6,0; 9,0) |
6,18 (4,0; 8,0) |
0,002 |
|
Вес, кг, Мед (НКв; ВКв) |
93,40 (76,0; 125,0) |
90,15 (85,0; 95,0) |
0,29 |
95,67 (88,00; 102,0) |
92,16 (87,00; 99,00) |
0,03 |
|
ИМТ, кг/м2, Мед (НКв; ВКв) |
33,69 (30,83; 35,35) |
32,64 (30,86; 34,19) |
0,34 |
33,81 (30,81; 35,99) |
32,60 (30,44; 34,21) |
0,02 |
|
ОТ, см, Мед (НКв; ВКв) |
105,3 (98,0; 111,0) |
102,2 (95,5; 110,0) |
0,26 |
106,29 (99,0; 113,0) |
104,43 (99,0; 110,0) |
0,04 |
|
ОБ, см, Мед (НКв; ВКв) |
110,65 (104,5; 118,0) |
108,45 (105,0; 113,0) |
0,42 |
111,08 (105,0; 115,0) |
108,85 (102,0; 115,0) |
0,07 |
Сокращения: ДД — диастолическая дисфункция, ИМТ — индекс массы тела, ОБ — окружность бедер, ОТ — окружность талии, тЭЖТ — толщина эпикардиальной жировой ткани.
В группах пациентов ДД+ и ДД- проведена оценка нейрогуморальной активности на момент включения пациентов в исследование. С этой целью выполнен сравнительный анализ уровней нейрогуморальных и профибротических факторов. В группе пациентов ДД+ уровень ФНО-α (р=0,02), ИЛ-6 (р=0,01), СЖК (р=0,001), коллагена I (р=0,001), коллагена III типа (р=0,02) был выше, а уровень адипонектина (р=0,001) ниже, чем в группе ДД-. Данный анализ представлен в таблице 4.
Таблица 4
Сравнительная оценка профибротических и нейрогуморальных факторов в группах ДД+ и ДД- на момент включения в исследование
|
Группы Показатель |
ДД+ (n=20) |
ДД- (n=73) |
р-уровень |
|
ФНО-α, пг/мл, Мед (НКв; ВКв) |
2,30 (1,70; 3,11) |
1,83 (1,19; 2,21) |
0,02 |
|
ИЛ-6, пг/мл, Мед (НКв; ВКв) |
3,05 (2,61; 3,62) |
2,41 (1,59; 2,89) |
0,01 |
|
СРБ, г/мл, Мед (НКв; ВКв) |
7,81 (5,12; 9,57) |
6,61 (3,54; 9,54) |
0,21 |
|
ИЛ-10, пг/мл, Мед (НКв; ВКв) |
7,85 (3,47; 10,36) |
8,31 (5,97; 10,36) |
0,64 |
|
Адипонектин, мг/мл, Мед (НКв; ВКв) |
5,06 (2,80; 6,99) |
8,23 (5,24; 10,79) |
0,0004 |
|
Рецептор к лептину, нг/мл, Мед (НКв; ВКв) |
19,17 (13,87; 21,73) |
18,60 (11,45; 24,19) |
0,81 |
|
Лептин, нг/мл, Мед (НКв; ВКв) |
47,00 (22,46; 73,03) |
42,29 (23,98; 58,41) |
0,43 |
|
СЖК, ммоль/л, Мед (НКв; ВКв) |
0,83 (0,61; 1,0) |
0,61 (0,39; 0,89) |
0,001 |
|
ММП-3, нг/мл, Мед (НКв; ВКв) |
17,41 (11,83; 18,86) |
16,80 (10,73; 19,80) |
0,77 |
|
Коллаген I типа, пг/мл, Мед (НКв; ВКв) |
43327,93 (37123,86; 47225,32) |
34062,82 (22478,32; 42361,01) |
0,001 |
|
TGF-β, нг/мл, Мед (НКв; ВКв) |
48,54 (39,17; 56,94) |
44,29 (33,00; 55,94) |
0,19 |
|
VEGFA, пг/мл, Мед (НКв; ВКв) |
76,26 (68,90; 79,60) |
71,71 (58,12; 79,60) |
0,30 |
|
PICP, пг/мл, Мед (НКв; ВКв) |
730,19 (534,60; 882,80) |
700,52 (612,20; 785,10) |
0,42 |
|
Коллаген III, пг/мл, Мед (НКв; ВКв) |
41220,34 (39265,47; 46488,96) |
35516,81 (26389,25; 41368,95) |
0,02 |
Примечание: р — достигнутый уровень значимости.
Сокращения: ИЛ-6 — интерлейкин-6, ИЛ-10 — интерлейкин-10, ММП-3 — матричная металлопротеиназа-3, СЖК — свободные жирные кислоты, СРБ — С-реактивный белок, ФНО-α — фактор некроза опухоли-α, TGF-β — трансформирующий фактор роста-β, PICP — проколлаген I C-концевого пропептида, VEGFA — васкулоэндотелиальный фактор роста.
Обсуждение
Ожирение — один из ФР возникновения СН, а снижение веса является общепризнанным подходом к профилактике СН. Так, в исследовании, проведенном Lavie C, et al. (2018), было показано, что у пациентов с тяжелым ожирением потеря веса после бариатрической хирургии приводит к увеличению уровня N-концевого промозгового натрийуретического пептида, концентрация которого, как известно, у пациентов с ожирением ниже, чем у пациентов с нормальным весом, в т.ч. при СН [12], одновременно с улучшением ДД ЛЖ [13]. Очевидно, это связано с тем, что потеря веса улучшает метаболический профиль и снижает связанное с ним системное воспаление. Однако крайне мало исследований, где бы изучались пациенты, у которых не развилась ДД ЛЖ. В связи с этим в данной работе проведен анализ группы пациентов, у которых через 4,7±0,3 лет наблюдения по результатам ЭхоКГ не была выявлена ДД ЛЖ.
По результатам нашего исследования были получены данные о том, что у 27 (26,7%) пациентов в течение 4,7±0,3 лет произошло снижение массы тела. Спустя 4,7±0,3 лет выявлено, что у 20 пациентов (19,8% от числа включенных в исследование) имеется нарушение диастолической функции ЛЖ, из них 18 (что составило 90% от числа выявленных пациентов с ДД ЛЖ) в группе с ЭО и 2 пациента (10% от числа выявленных пациентов с ДД) в группе без ЭО. Наши данные согласуются с имеющимися данными литературы. Так, в одном из проспективных исследований, в котором оценивалась диастолическая функция ЛЖ при ожирении, через 20 лет наблюдения ДД ЛЖ развилась у 26,2% пациентов [14].
При оценке тЭЖТ у пациентов с ожирением (n=101) на момент включения и в динамике через 4,7±0,3 лет (n=93) статистически значимых различий не выявлено, имеется тенденция к уменьшению данного показателя на 0,5 мм, обусловленная, видимо, тем, что были пациенты, у которых снизилась масса тела. У пациентов с развившейся ДД ЛЖ антропометрические показатели и тЭЖТ, измеренные исходно и через 4,7±0,3 лет, статистически значимых отличий не имели. Тогда как в группе пациентов, у которых ДД ЛЖ не развилась, наблюдалось уменьшение веса (р=0,03), ИМТ (р=0,02), ОТ (р=0,04) и тЭЖТ (р=0,002). Уменьшение показателя тЭЖТ в группе пациентов, у которых ДД ЛЖ не развилась в период наблюдения, подтверждает данные о существенном вкладе ЭО в развитие метаболических нарушений при ожирении, лежащих в основе липотоксического поражения миокарда. Нами показано, что у пациентов, у которых впоследствии не развилась ДД ЛЖ, исходно наблюдалась низкая гормональная активность висцеральной жировой ткани, что подтверждается наличием более низкого уровня ФНО-α (р=0,02), ИЛ-6 (р=0,01), СЖК (р=0,001) и высокого уровня адипонектина (р=0,001). Также у этих пациентов исходно уровень профибротических факторов коллагена I (р=0,001) и коллагена III типа (р=0,02) был ниже. При снижении массы тела уменьшается тЭЖТ, а также уменьшается выделение биологически активных веществ, участвующих в липотоксическом поражении миокарда, в связи с этим уменьшается влияние ЭО на миокард, соответственно, ДД ЛЖ не развивается. Наши данные согласуются с современными литературными данными, подтверждающими, что именно висцеральное ожирение является маркером сердечно-сосудистого риска [5]. Однако при проведении анализа литературы выявлено, что в настоящее время имеется мало доказательств того, что снижение массы тела при СН приводит к улучшению основных клинических исходов или улучшению выживаемости. Показано, что потеря массы тела может уменьшить симптомы СН и улучшить качество жизни [2].
Заключение
Таким образом, уменьшение веса, ИМТ, ОТ и тЭЖТ за период наблюдения в течение 4,7±0,3 лет предупреждало развитие ДД ЛЖ, что связано со снижением риска развития липотоксического поражения миокарда на фоне ЭО. В связи с этим необходима разработка эффективных стратегий для снижения массы тела у пациентов с ожирением с целью снижения риска развития ДД ЛЖ. Кроме того, крайне актуальным является последующее поддержание веса, т.к. кратковременное снижение веса может быть недостаточным для полного преодоления неблагоприятного воздействия ожирения на сердечно-сосудистую систему.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Список литературы
1. Mahmood S, Levy D, Vasan R, et al. The Framingham Heart Study and the Epidemiology of Cardiovascular Diseases: A Historical Perspective. Lancet. 2014;383(9921):999-1008. doi:10.1016/S0140-6736(13)61752-3.
2. Powell-Wiley TM, Poirier Р, Lora EВ, et al. Obesity and Cardiovascular Disease. A Scientific Statement From the American Heart Association. Circulation. 2021;143(21):e984e1010. doi:10.1161/CIR.0000000000000973.
3. Bozkurt B, Aguilar D, Deswal A, et al. Contributory risk and management of comorbidities of hypertension, obesity, diabetes mellitus, hyperlipidemia, and metabolic syndrome in chronic heart failure: a scientific statement from the American Heart Association. Circulation. 2016;134:e535-78. doi:10.1161/CIR.0000000000000450.
4. Heidenreich PA, Bozkurt B, Aguilar D, et al. 2022 AHA/ACC/HFSA Guideline for the Management of Heart Failure: A Report of the American College of Cardiology/ American Heart Association Joint Committee on Clinical Practice Guidelines. Circulation. 2022;145:e895-1032. doi:10.1161/CIR.0000000000001063.
5. Кузнецова Т. Ю., Чумакова Г. А., Дружилов М. А. и др. Роль количественной эхокардиографической оценки эпикардиальной жировой ткани у пациентов с ожирением в клинической практике. Российский кардиологический журнал. 2017;(4):81-7. doi:10.15829/1560-4071-2017-4-81-87.
6. Piek A, de Boer RA, Silljé HH. The fibrosis‐cell death axis in heart failure. Heart Fail Rev. 2016;21:199-211. doi:10.1007/s10741-016-9536-9.
7. Дружилов М. А., Бетелева Ю. Е., Дружилова О. Ю. и др. Роль эпикардиального ожирения в развитии структурнофункционального ремоделирования сердца. Российский кардиологический журнал. 2017;(4):35-9. doi:10.15829/1560-4071-2017-4-35-39.
8. Чумакова Г. А., Гриценко О. В., Груздева О. В. и др. Прогнозирование риска развития диастолической дисфункции левого желудочка при ожирении. Российский кардиологический журнал. 2022;27(4):4811. doi:10.15829/1560-4071-2022-4811.
9. Ebong IA, Goff DC, Rodriguez СJ, et al. Mechanisms of Heart Failure in Obesity. Obes Res Clin Pract. 2014;8(6):e540-8. doi:10.1016/j.orcp.2013.12.005.
10. Iacobellis G, Willens HJ. Echocardiographic Epicardial Fat: A Review of Research and Clinical Applications. JASE. 2009;22(12):1311-9. doi:10.1016/j.echo.2009.10.013.
11. Веселовская Н. Г., Чумакова Г. А., Отт А. В. и др. Альтернативный способ оценки висцерального ожирения при диагностике метаболического синдрома. Российский кардиологический журнал. 2014;(3):82-6. doi:10.15829/1560-40712014-3-82-86.
12. Lavie CJ, Laddu D, Arena R, et al. Reprint of: healthy weight and obesity prevention: JACC Health Promotion Series. J Am Coll Cardiol. 2018;72(23 Pt B):3027-52. doi:10.1016/j.jacc.2018.10.024.
13. Martin J, Bergeron S, Pibarot P, et al. Impact of bariatric surgery on N-terminal fragment of the prohormone brain natriuretic peptide and left ventricular diastolic function. Can J Cardiol. 2013;29:969-75. doi:10.1016/j.cjca.2012.11.010.
14. Chau K, Girerd N, Magnusson M, et al. Obesity and metabolic features associated with long-term developing diastolic dysfunction in an initially healthy population-based cohort. Clin Res Cardiol. 2018;107(10):887-96. doi:10.1007/s00392-018-1259-6.
Об авторах
О. В. ГриценкоРоссия
Гриценко Ольга Валерьевна — кандидат медицинских наук, младший научный сотрудник лаборатории исследований гомеостаза отдела экспериментальной медицины, врач кардиолог общебольничного отделения
Кемерово, Барнаул
Г. А. Чумакова
Россия
Чумакова Галина Александровна — доктор медицинских наук, профессор, профессор кафедры терапии и общей врачебной практики
Барнаул
О. В. Груздева
Россия
Груздева Ольга Викторовна — доктор медицинских наук, профессор РАН, заведующий лабораторией исследований гомеостаза отдела экспериментальной медицины
Кемерово
Е. А. Субботин
Россия
Субботин Евгений Александрович — кандидат медицинских наук, доцент кафедры физики и информатики
Барнаул
Дополнительные файлы
Рецензия
Для цитирования:
Гриценко О.В., Чумакова Г.А., Груздева О.В., Субботин Е.А. Возможности управления риском развития сердечной недостаточности у больных с ожирением. Российский кардиологический журнал. 2023;28(4):5363. https://doi.org/10.15829/1560-4071-2023-5363
For citation:
Gritsenko O.V., Chumakova G.A., Gruzdeva O.V., Subbotin E.A. Possibilities for managing the left ventricular diastolic dysfunction risk in obese patients. Russian Journal of Cardiology. 2023;28(4):5363. (In Russ.) https://doi.org/10.15829/1560-4071-2023-5363

















































