Перейти к:
Взаимосвязь степени повреждения миокарда по данным магнитно-резонансной томографии сердца с контрастированием и лабораторных данных у пациентов с острым инфарктом миокарда
https://doi.org/10.15829/1560-4071-2022-5226
Аннотация
Цель. Оценить информативность комплекса клинических показателей и биохимических маркеров повреждения миокарда в прогнозировании развития трансмурального поражения миокарда (ТПМ) по данным магнитно-резонансной томографии (МРТ) у пациентов с острым инфарктом миокарда (ОИМ).
Материал и методы. В исследование были включены пациенты, поступившие в отделение неотложной кардиологии с острым коронарным синдромом. Всем пациентам была выполнена инвазивная коронарная ангиография, проведены лабораторно-диагностические исследования, динамическое определение кардиоспецифических ферментов. В интервале 6,1±4 дней от поступления в стационар пациентам была выполнена МРТ сердца с контрастированием. По паттерну отсроченного контрастирования пациенты были разделены на две группы: с ТПМ и субэндокардиальным (ЭПМ) паттерном поражения.
Результаты. Средний возраст пациентов 62,5±10,5 лет, 27 (71,1%) имели ОИМ с подъемом сегмента ST. Среди факторов риска ишемической болезни сердца наиболее часто имели место дислипидемия (89,5%), гипертоническая болезнь (68,4%), курение (57,9%). Значения креатинфосфокиназы-МВ (КФКМВ), высокочувствительного сывороточного сердечного тропонина I (cTnI) и С-реактивного белка (СРБ) через 24 ч были статистически значимо выше у пациентов с ТПМ. Была выявлена средней силы положительная взаимосвязь между глобальным размером повреждения миокарда левого желудочка (ЛЖ) по данным МРТ и уровнями КФК-МВ ч/з 24 ч и 4 дня, СРБ ч/з 24 ч, 4 и 7 дней; уровнем cTnI ч/з 24 ч и 4 дня. В группе пациентов с ТПМ глобальный размер повреждения миокарда ЛЖ был достоверно выше. Пациенты данной группы характеризовались более частой встречаемостью микроваскулярной обструкции. При однофакторном регрессионном анализе статистически значимыми предикторами развития ТПМ были: КФК-МВ ч/з 4 дня (р=0,023) и подъем сегмента ST (p=0,029). Многофакторный регрессионный анализ показал, что единственным независимым предиктором развития ТПМ было повышение КФКМВ ч/з 4 дня (p=0,023).
Заключение. Независимым предиктором ТПМ ЛЖ при ОИМ был повышенный уровень КФК-МВ ч/з 4 дня, однако данный лабораторный маркер имел неудовлетворительную информационную полноту и прогностическое качество. В связи с этим проведение МРТ сердца у пациентов с ОИМ по сравнению со стандартной клинической оценкой можно считать предпочтительным для оценки глубины повреждения миокарда, стратификации риска и прогноза.
Ключевые слова
Для цитирования:
Мочула О.В., Сулейманова А.С., Сухарева А.Е., Рябов В.В., Завадовский К.В. Взаимосвязь степени повреждения миокарда по данным магнитно-резонансной томографии сердца с контрастированием и лабораторных данных у пациентов с острым инфарктом миокарда. Российский кардиологический журнал. 2022;27(11):5226. https://doi.org/10.15829/1560-4071-2022-5226
For citation:
Mochula O.V., Sulejmanova A.S., Sukhareva A.E., Ryabov V.V., Zavadovsky K.V. Relationship between the degree of myocardial damage according to contrast-enhanced cardiac magnetic resonance imaging and laboratory data in patients with acute myocardial infarction. Russian Journal of Cardiology. 2022;27(11):5226. (In Russ.) https://doi.org/10.15829/1560-4071-2022-5226
Последние четыре десятилетия острый инфаркт миокарда (ОИМ) остается ведущей причиной заболеваемости и смертности во всем мире, несмотря на значительные успехи в лечении и заметном улучшении прогноза после острого события [1].
Хорошо известно, что магнитно-резонансная томография (МРТ) сердца с контрастным усилением обладает высокой диагностической точностью выявления рубцовой ткани после ОИМ и позволяет идентифицировать даже небольшое субэндокардиальное повреждение [2]. Размер данных изменений на отсроченных контрастных (ОК) МРТ изображениях может варьировать от трансмурального, вплоть до его полного отсутствия [3][4]. Определение трансмуральности ОК может предоставить клинически ценную информацию для дальнейшей тактики лечения, поскольку реваскуляризация является эффективной только для жизнеспособного миокарда [5][6]. Кроме того, объем повреждения миокарда выступает определяющим фактором ремоделирования левого желудочка (ЛЖ) у лиц, перенесших ОИМ, а также является важным предиктором исхода [7][8]. Определение факторов, предсказывающих размер инфаркта миокарда (ИМ), в т.ч. его трансмуральность, может способствовать ранней стратификации риска еще до выполнения кардиовизуализации.
Представленные по данному направлению научные работы преимущественно ориентированы на оценку взаимосвязи лабораторных показателей и размера ИМ и на прогнозирование развития микроваскулярного повреждения (микроваскулярная обструкция (МВО)) миокарда у пациентов с ОИМ [1][9]. Немногочисленные исследования посвящены изучению вариативности степени повреждения миокарда и ее связи с лабораторными данными; в частности, показано, что повышение биомаркеров тесно связано с размером хронического рубца при нетрансмуральном ИМ и является сильным прогностическим фактором наличия отсроченного контрастного усиления [2][10]. Однако в данных исследованиях не учитывался острый период ИМ, а также не анализировалась трансмуральность повреждения миокарда по результатам МРТ сердца с контрастированием.
Целью данного исследования была оценка информативности комплекса клинических показателей и биохимических маркеров повреждения миокарда в прогнозировании развития трансмурального поражения миокарда (ТПМ) по данным МРТ у пациентов с ОИМ.
Материал и методы
Пациенты и дизайн исследования. В исследование последовательно были включены пациенты обоего пола, поступившие в отделение неотложной кардиологии с острым коронарным синдромом в период с 2021 по 2022гг. Всем пациентам была выполнена инвазивная коронарная ангиография (иКАГ) в течение 24 ч при ОИМ с подъемом сегмента ST и 72 ч в случае ОИМ без подъема сегмента ST. Согласно стандартам оказания скорой медицинской помощи проведены лабораторно-диагностические исследования, динамическое определение кардиоспецифических ферментов. В интервале 10 дней от поступления в стационар была выполнена МРТ сердца с контрастированием (рис. 1). Другими критериями включения в исследование были возраст 18-80 лет, а также наличие обструктивного поражения коронарных артерий (КА) (>50%) по данным иКАГ.
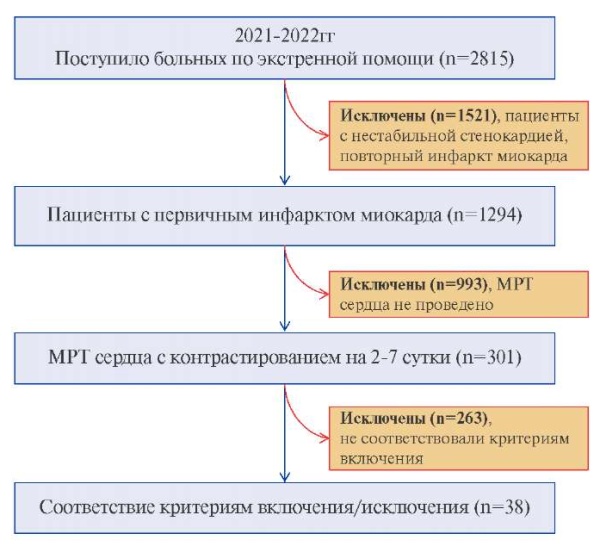
Рис. 1. Дизайн исследования.
Сокращение: МРТ — магнитно-резонансная томография.
Критерии исключения пациентов из исследования:
- Противопоказания для проведения МРТ (кардиостимулятор, клаустрофобия, ферромагнитные/ электронные имплантаты среднего уха и т.д.) .
- Миокардит по данным МРТ.
- Субоптимальное качество магнитно-резонансного исследования.
- Необструктивное поражение КА.
- Нестабильная стенокардия.
- Нестабильная гемодинамика: отек легких, кардиогенный шок (Killip III, IV).
- Эндоваскулярная и/или хирургическая реваскуляризация миокарда в анамнезе.
- Острые психические расстройства (соматогенный делирий).
- Хроническая болезнь почек 4-5 стадии (скорость клубочковой фильтрации <30 мл/мин).
- Тяжелая сопутствующая патология.
- Отказ пациента от участия в исследовании.
Инвазивная КАГ была выполнена на ангиографическом аппарате Axiom Artis (Siemens; Erlangen, Германия). Определение степени стенозирования КА было выполнено опытным врачом по рентгенэндоваскулярной диагностике и лечению.
В дальнейшем по МРТ паттерну ОК миокарда ЛЖ пациенты были подразделены на две группы: 1) с трансмуральным паттерном поражения миокарда (ТПМ) одного и более сегментов ЛЖ (>50% контрастирования толщины сегмента); 2) с субэндокардиальным паттерном поражения (ЭПМ) одного и более сегментов ЛЖ (<50% контрастирования толщины сегмента).
Исследование было выполнено в соответствии со стандартами надлежащей клинической практики (Good Clinical Practice), соответствует принципам Хельсинкской декларации. Протокол исследования был одобрен локальным этическим комитетом. До включения в исследование у всех участников было получено письменное информированное согласие.
Лабораторный анализ. Миокардиальный изофермент креатинфосфокиназы (КФК-MB), С-реактивный белок (СРБ) в сыворотке крови определяли четырехкратно (при поступлении, через 24 ч, 4 сут. и 7 сут. после поступления). Уровень КФК-MB определяли с помощью автоматизированной системы для иммунологических и фотометрических тестов Cobas 6000 (Roche Diagnostics, Швейцария). Лабораторный эталонный порог нормы для КФК-МВ (0,00-25,00) ед/л; для СРБ (0,00-10,00) мг/л. Высокочувствительный сывороточный сердечный тропонин I (cTnI) определяли четырехкратно в эти же сроки с помощью иммунохимического анализатора Immunoassay Systems Access (Brea, USA). Верхний предел нормы принимали за 99-й процентиль от верхнего референтного уровня (лабораторный эталонный порог нормы cTnI <0,04 нг/мл).
МРТ сердца. МРТ сердца с контрастным усилением была выполнена всем пациентам на томографе Vantage Titan (Toshiba, Япония) c напряженностью магнитного поля 1,5 Тл с использованием 8-канальной приемной катушки. Протокол включал стандартные импульсные последовательности (ИП): ИП TSE, взвешенные по Т1 и T2 по короткой оси в двухкамерной проекции; кино-изображения (ИП GRESSFP) — по короткой и длинной осям в двух/четырехкамерной проекциях; ИП TSE Т1-взвешенных изображениях (ВИ) в раннюю фазу контрастирования и ОК в ИП GRE режим "Inversion recovery" с подбором времени инверсии через 8-15 мин после внутривенного ведения контрастного препарата по короткой оси в двухкамерной проекции, по длинной оси в двух/четырех камерных проекциях. В качестве контрастного вещества был использован парамагнитный контрастный препарат гадобутрол (Гадовист, Bayer AG, Германия) из расчета 0,15-0,2 мл на 1 кг массы тела пациента.
Данные МРТ сердца были проанализированы независимо от результатов иКАГ в соответствии с 17-сегментарной моделью Американской ассоциации кардиологов. На Т2-ВИ качественно оценивали наличие и локализацию отека миокарда, на Т1-ВИ до и после контрастирования качественно оценивали наличие и локализацию гиперемии миокарда. На постконтрастных изображениях в IR-режиме качественно оценивали наличие, характер, степень некроза/рубца. Паттерн острого ишемического повреждения миокарда ЛЖ представлял собой усиление интенсивности сигнала на Т2-ВИ, как признак отека, и ОК с ишемическим характером контрастирования — субэндокардиальным, трансмуральным в сегментах, соответствующих бассейнам кровоснабжения КА.
Для определения суммарного показателя ОК [11] каждому сегменту присваивали балл в зависимости от глубины ОК; затем все баллы суммировали и делили на максимально возможную сумму баллов для всего ЛЖ; полученный результат выражали в процентах (рис. 2). Обработку изображений выполнили с использованием научно-исследовательского оборудования "Медицинская геномика" на базе Центра коллективного пользования.
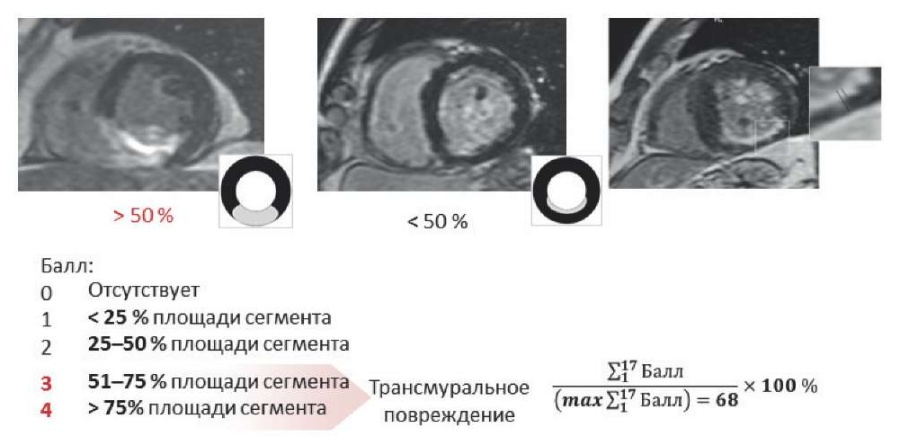
Рис. 2. Определение глобального размера контрастирования миокарда ЛЖ.
Непрерывные количественные данные представлены как среднее значение ± стандартное отклонение при нормальном распределении (тест Shapiro-Wilk) или как медиана и межквартильный размах для данных, не подчиняющихся нормальному закону распределения. Категориальные данные представлены в виде частот и процентов от общего числа. Для сравнения групп с категориальными данными применяли точный двусторонний тест Fisher. Значимость различий в группах оценивали непараметрическим тестом Mann-Whitney. Силу взаимосвязи между признаками определяли с помощью корреляционного анализа по Spearman (ρ). Для оценки связи различных факторов использовали методы логистической регрессии. Переменные с р<0,05 в однофакторном анализе были включены в пошаговую многомерную модель. Статистический анализ данных проводился с использованием STATISTICA (Stat Soft, Inc., v.10.01011.0), Jamovi 2.2.5. Статистически значимым считалось значение p<0,05.
Исследование выполнено за счет гранта Российского научного фонда № 21-75-00051, https://rscf.ru/project/21-75-00051/.
Результаты
Клиническая характеристика пациентов
Согласно критериям включения и исключения, в исследование вошло 38 пациентов с ОИМ, которым была выполнена МРТ сердца с контрастированием в интервале 6,1±4 дней от поступления в стационар. Клиническая характеристика пациентов представлена в таблице 1. Средний возраст пациентов 62,5±10,5 лет, мужчины составили 62,1%, имели ОИМ с подъемом сегмента ST 27 (71,1%). Среди факторов риска ишемической болезни сердца наиболее часто имели место дислипидемия (89,5%), гипертоническая болезнь (68,4%), курение (57,9%). Всем пациентам была проведена реперфузионная терапия посредством первичного чрескожного коронарного вмешательства (ЧКВ) на инфаркт-связанной КА, со стентированием у 74% пациентов, 13 (34%) пациентов на догоспитальном этапе получили тромболитическую терапию (ТЛТ). Частота проведения ТЛТ на догоспитальном этапе была выше в группе с ТПМ. Время проведения ЧКВ с момента начала симптомов составило не >6 ч.
Таблица 1
Клиническая и МРТ характеристика пациентов

Сокращения: ДАД — диастолическое артериальное давление, ИМТ — индекс массы тела, КФК-МВ — креатинкиназа-МВ, МВО — микроваскулярная обструкция, МРТ — магнитно-резонансная томография, САД — систолическое артериальное давление, СРБ — С-реактивный белок, cTnI — тропонин I высокочувствительный, ТЛТ — тромболитическая терапия, ТПМ — трансмуральное поражение миокарда, ЧКВ — чрескожное коронарное вмешательство, ЭПМ — субэндокардиальное поражение миокарда.
Результаты иКАГ
Общая выборка пациентов характеризовалась преимущественно правым типом кровообращения (76%). В группе пациентов с ТПМ: в 39% случаев был выявлен тромбоз КА; стенозирующее атеросклеротическое поражение передней нисходящей артерии и правой КА (ПКА), 78% и 70%, соответственно, с установкой стентов в указанные КА, в 39% и 43% случаев, соответственно. У 17 (74%) пациентов было выявлено однососудистое поражение КА, 1 случай (4%) двухи трехсосудистого поражения, у 4 (17%) пациентов стент не был установлен.
В группе пациентов с ЭПМ в бассейнах огибающей артерии, передней нисходящей артерии и ПКА было выявлено стенозирующее атеросклеротическое поражение (53%, 47% и 60%, соответственно), с преимущественной установкой стентов в ПКА (33%). Пациенты с ЭПМ характеризовались только однососудистым поражением КА — 9 (60%), у 6 (40%) пациентов стент не был установлен. Детальная характеристика результатов иКАГ представлена в таблице 2.
Таблица 2
Данные иКАГ
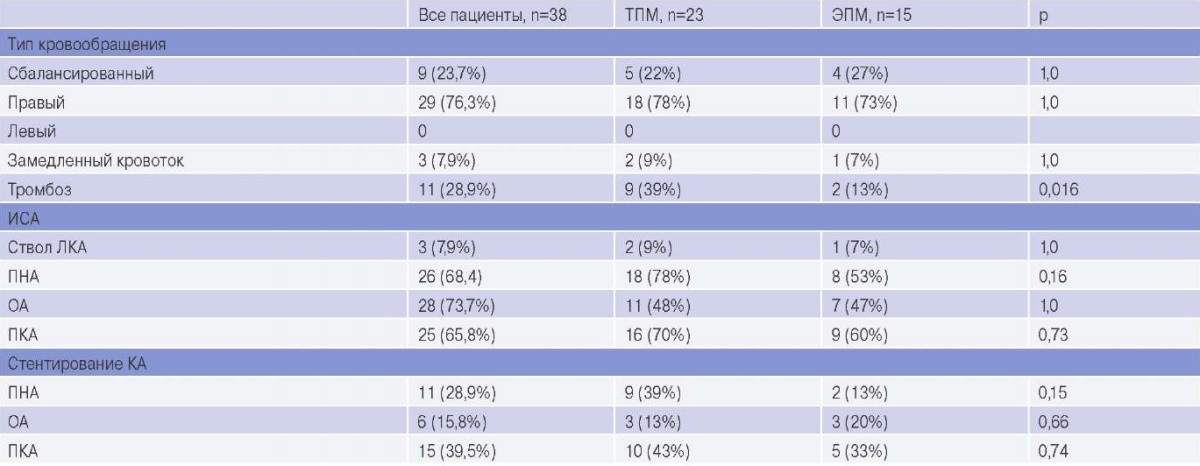
Сокращения: ИСА — инфаркт-связанная коронарная артерия, КА — коронарная артерия, ЛКА — левая коронарная артерия, ОА — огибающая артерия, ПКА — правая коронарная артерия, ПНА — передняя нисходящая артерия, ТПМ — трансмуральное поражение миокарда, ЭПМ — субэндокардиальное поражение миокарда, p — уровень значимости двустороннего теста Fisher.
Клинико-лабораторные показатели и степень повреждения миокарда ЛЖ
Значения КФК-МВ, cTnI и СРБ через 24 ч были статистически значимо выше у пациентов с ТПМ по сравнению с группой ЭПМ (табл. 1). Повышение активности КФК-МВ у лиц группы ТПМ, по сравнению с пациентами группы ЭПМ, сохранялось через 4 дня.
МРТ
В группе пациентов с ТПМ глобальный размер повреждения миокарда ЛЖ был достоверно выше. Пациенты данной группы также характеризовались более частой встречаемостью МВО.
Корреляционный анализ данных МРТ сердца и биохимических маркеров повреждения
При анализе всей выборки была выявлена средней силы положительная взаимосвязь между глобальным размером повреждения миокарда ЛЖ по данным МРТ и уровнями КФК-МВ ч/з 24 ч и 4 дня, СРБ ч/з 24 ч, 4 и 7 дней; уровнем cTnI ч/з 24 ч и 4 дня (табл. 3).
Таблица 3
Данные корреляционного анализа глобального размера повреждения миокарда ЛЖ по данным МРТ сердца и биохимических маркеров
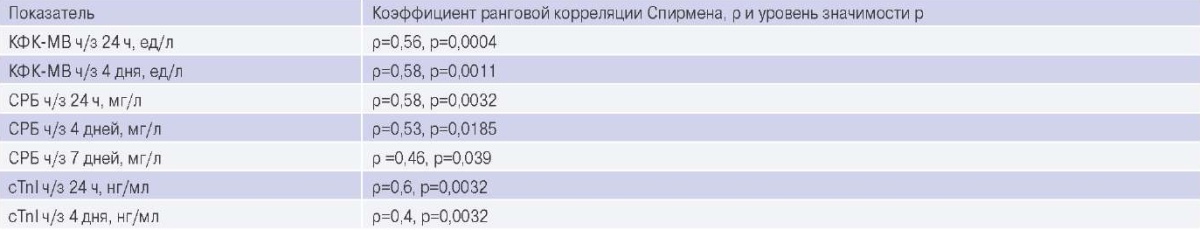
Сокращения: КФК-МВ — креатинкиназа-МВ, СРБ — С-реактивный белок, cTnI — тропонин I высокочувствительный.
Ассоциация между клинико-лабораторными факторами и ТПМ ЛЖ
Для ряда клинически значимых факторов риска развития ТПМ были рассчитаны отношения шансов и их доверительные интервалы (табл. 4). При однофакторном регрессионном анализе статистически значимыми предикторами развития ТПМ были: КФК-МВ ч/з 4 дня (р=0,023) и подъем сегмента ST (p=0,029).
Таблица 4
Результаты одно- и многофакторного анализа развития ТПМ ЛЖ
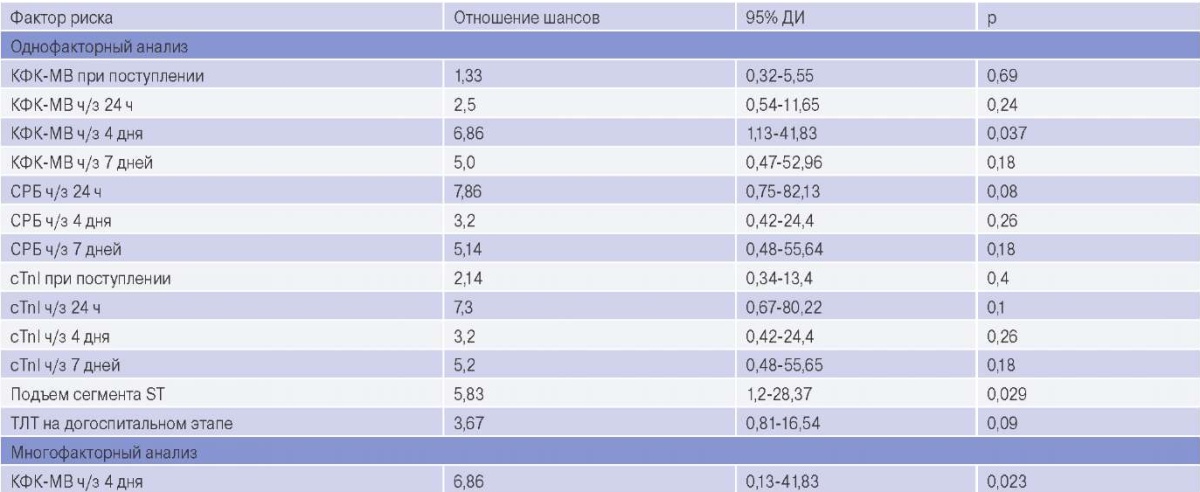
Примечание: значения биохимических маркеров проанализированы как категориальные показатели по значениям превышения нормы.
Сокращения: ДИ — доверительный интервал, КФК-МВ — креатинкиназа-МВ, ТЛТ — тромболитическая терапия, СРБ — С-реактивный белок, cTnI — тропонин I высокочувствительный, р — уровень значимости.
Многофакторный регрессионный анализ показал (табл. 4), что единственным независимым предиктором развития ТПМ было повышение КФК-МВ ч/з 4 дня (p=0,023; коэффициент псевдо-рандомизации Найджелкерка R2=0,225; предсказательная эффективность VIF=1, tolerance=1). При выполнении ROC анализа было установлено, что данный показатель имеет площадь под кривой (AUC) =0,72 и позволяет прогнозировать развитие ТПМ с чувствительностью 63%, специфичностью 80% и диагностической точностью 69% (рис. 3) и имеет следующие операционные характеристики: положительная прогностическая ценность — 85,7%, отрицательная прогностическая ценность — 53,3%; положительное отношение правдоподобия — 3,2; отрицательное отношение правдоподобия — 0,5.
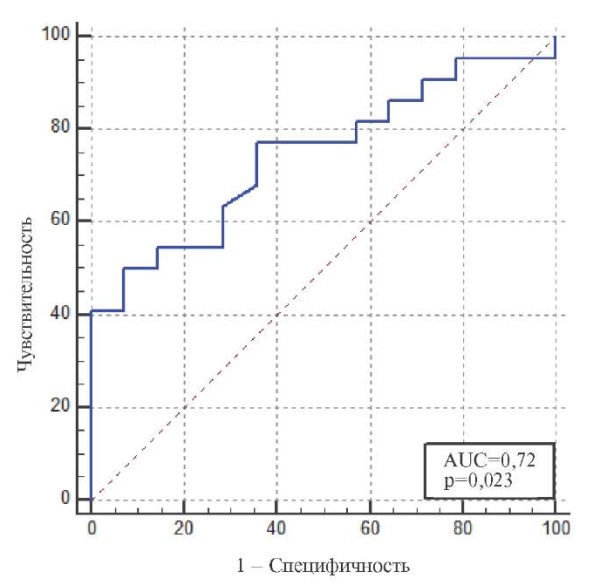
Рис. 3. ROC-кривая диагностической информативности КФК-МВ ч/з 4 дня в предикации наличия ТПМ.
Обсуждение
В ходе исследования было установлено, что наиболее значимым предиктором развития ТПМ ЛЖ при ОИМ является повышение уровня КФК-МВ ч/з 4 дня, обладающее необходимой предсказательной эффективностью, но имеющее неудовлетворительную информационную полноту и прогностическое качество.
Известно, что маркеры повреждения миокарда являются информативными предикторами клинического исхода у пациентов с ОИМ [12]. Кроме того, ранние исследования показали корреляцию между сердечными маркерами и размером ИМ [13]. При этом только в нескольких работах была изучена взаимосвязь между лабораторными показателями и размером инфаркта по данным МРТ. Примечательно, что большинство этих исследований было ориентировано на оценку роли биомаркеров в диагностике микрососудистого повреждения. В исследовании Тереничевой М. А. и др. (2021) [1] были выявлены факторы, ассоциированные с увеличением размера инфаркта и ухудшением прогноза больных (МВО, гетерогенная зона). В качестве лабораторных показателей были использованы N-концевой промозговой натрийуретического пептид (NT-proBNP), КФК-МВ, СРБ. Было показано, что независимыми предикторами развития МВО являются сахарный диабет 2 типа, размер ИМ, повышение концентрации NTproBNP и КФК-МВ, а рост уровней КФК-МВ и NTproBNP ассоциируется с большим размером ИМ.
Схожие данные получены в работе Русак Т. В. и др. (2021), где МВО была ассоциирована с более высокими концентрациями сTnI, NT-proBNP, СРБ и стимулирующего фактора роста в раннем постинфарктном периоде. В нашем исследовании впервые показано, что, несмотря на наличие ассоциации между степенью трансмуральности ОК и КФК-МВ, информативность данного лабораторно маркера не позволяет с высокой точностью судить о выраженности и глубине повреждения миокарда.
В научной литературе имеются немногочисленные работы, исследующие вариативность трансмуральности повреждения миокарда и ее связи с биомаркерами. В работе Pöyhönen P, et al. (2018) [10] изучалось пиковое значение КФК-МВ через 12-24 ч у пациентов с нетрансмуральным ИМ в период 1 и 10 мес. после госпитализации, причем лишь 19% пациентов с подъемом сегмента ST имели трансмуральный ИМ. Авторами показано, что значение КФКМВ тесно связано с размером хронического рубца при нетрансмуральном ИМ и позволяет прогнозировать локальную и глобальную функцию ЛЖ. Другое исследование с участием 136 пациентов продемонстрировало, что значение КФК-МВ было сильным прогностическим фактором наличия отсроченного контрастного усиления [14]. Наши результаты, взятые в контексте этих исследований, расширяют полученные данные, поскольку повышение КФК-МВ, определенное через 4 дня после госпитализации, является значимым предиктором развития ТПМ.
Результаты нашего исследования согласуются с данными, полученными Rakowski T, et al. (2014) [2], согласно которым КФК-МВ является информативным предиктором размера ИМ. Однако авторы изучали уровень КФК-МВ в срок через 6, 12, 18, 24 и 48 ч после госпитализации, оценивали взаимосвязь с размером инфаркта по данным МРТ через 6 мес. Результаты нашего исследования дополняют полученные результаты за счет анализа уровня КФК-МВ в срок через 4 и 7 дней с результатами МРТ в острый период.
В исследовании, в котором приняли участие 119 пациентов с ОИМ, сравнивали значения cTn, КФКМВ и NT-proBNP с показателями ранней морфологической оценки миокарда с помощью МРТ через 4±2 дня. Авторы показали, что корреляция cTn с размером инфаркта и фракцией выброса в долгосрочной перспективе (через 6 мес.) была сопоставима с ранней оценкой размера инфаркта и фракции выброса с помощью МРТ [15]. Аналогичные результаты были получены в работе Nguyen TL, et al. (2015) [16], где продемонстрировано, что пиковые уровни тропонина через 48 и 72 ч после ОИМ независимо предсказывают большой размер инфаркта. В свою очередь Klug G, et al. (2011) [17] описали корреляцию между cTn через 3-4 дня, уровнем КФК-МВ и размером инфаркта. Однако в нашем исследовании выявить ассоциацию высокочувствительного тропонина с наличием трансмуральности повреждения миокарда не удалось, что может быть связано с ограниченным объемом выборки.
Ограничения исследования. Основным ограничением настоящего исследования является относительно небольшое число включенных в него пациентов. Тем не менее на данном материале удалось выявить статистические различия в уровнях биомаркеров у пациентов с ТПМ и ЭПМ, а также оценить наличие корреляционной связи между лабораторными данными и размером ИМ.
Заключение
По результатам исследования независимым предиктором ТПМ ЛЖ при ОИМ был повышенный уровень КФК-МВ ч/з 4 дня, однако данный лабораторный маркер имел неудовлетворительную информационную полноту и прогностическое качество. В связи с этим проведение МРТ сердца у пациентов с ОИМ по сравнению со стандартной клинической оценкой можно считать предпочтительным для оценки глубины повреждения миокарда, стратификации риска и прогноза.
Отношения и деятельность. Исследование выполнено за счет гранта Российского научного фонда № 21-75-00051, https://rscf.ru/project/21-75-00051/.
Список литературы
1. Raghunathan D, Khilji MI, Hassan SA, et al. Radiation-Induced Cardiovascular Disease. Curr Atheroscler Rep. 2017;19(5):22. doi:10.1007/s11883-017-0658-x.
2. Nottage KA, Ness KK, Li C, et al. Metabolic syndrome and cardiovascular risk among long-term survivors of acute lymphoblastic leukaemia — From the St. Jude Lifetime Cohort. Br J Haematol. 2014;165(3):364-74. doi:10.1111/bjh.12754.
3. Warris LT, van den Akker EL, Bierings MB, et al. Acute Activation of Metabolic Syndrome Components in Pediatric Acute Lymphoblastic Leukemia Patients Treated with Dexamethasone. PLoS One. 2016;11(6):e0158225. doi:10.1371/journal.pone.0158225.
4. van Dijk IW, van der Pal HJ, van Os RM, et al. Risk of Symptomatic Stroke After Radiation Therapy for Childhood Cancer: A Long-Term Follow-Up Cohort Analysis. Int J Radiat Oncol Biol Phys. 2016;96(3):597-605.
5. Fullerton HJ, Stratton K, Mueller S, et al. Recurrent stroke in childhood cancer survivors. Neurology. 2015;85(12):1056-64.
6. van den Belt-Dusebout AW, Nuver J, de Wit R, et al. Long-term risk of cardiovascular disease in 5-year survivors of testicular cancer. J Clin Oncol. 2006;24(3):467-75. doi:10.1200/JCO.2005.02.7193.
7. Coumbe BGT, Groarke JD. Cardiovascular Autonomic Dysfunction in Patients with Cancer. Curr Cardiol Rep. 2018;20(8):69. doi:10.1007/s11886-018-1010-y.
8. Bayram C, Yaralı N, Fettah A, et al. Evaluation of Endocrine Late Complications in Childhood Acute Lymphoblastic Leukemia Survivors: A Report of a Single-Center Experience and Review of the Literature. Turk J Haematol. 2017;34(1):40-5. doi:10.4274/tjh.2015.0332.
9. Lin PY, Cheng PC, Hsu WL, et al. Risk of CVD Following Radiotherapy for Head and Neck Cancer: An Updated Systematic Review and Meta-Analysis. Front Oncol. 2022;12:820808. doi:10.3389/fonc.2022.820808.
10. Cacciotti C, Chordas C, Valentino K, et al. Cardiac dysfunction in medulloblastoma survivors treated with photon irradiation. Neurooncol Pract. 2022;9(4):338-43. doi:10.1093/nop/npac030.
11. Siviero-Miachon AA, Monteiro CM, Pires LV, et al. Early traits of metabolic syndrome in pediatric post-cancer survivors: outcomes in adolescents and young adults treated for childhood medulloblastoma. Arq Bras Endocrinol Metabol. 2011;55(8):653-60. doi:10.1590/s0004-27302011000800022.
12. Целовальникова Т. Ю., Павлова М. Г., Зилов А. В. и др. Метаболические нарушения у пациентов после комплексного лечения медуллобластомы и острого лимфобластного лейкоза. Ожирение и метаболизм. 2015;12(3):3-9. doi:10.14341/omet201533.
13. Ness KK, Plana JC, Joshi VM, et al. Exercise Intolerance, Mortality, and Organ System Impairment in Adult Survivors of Childhood Cancer. J Clin Oncol. 2020;38(1):29-42. doi:10.1200/JCO.19.01661
Об авторах
О. В. МочулаРоссия
Кандидат медицинских наук, научный сотрудник отделения рентгеновских и томографических методов диагностики.
Томск, SPIN-код: 3712-8492
Конфликт интересов:
отсутствует
А. С. Сулейманова
Россия
Кардиолог отделения неотложной кардиологии.
Томск
Конфликт интересов:
отсутствует
А. Е. Сухарева
Россия
Кандидат медицинских наук, младший научный сотрудник отделения рентгеновских и томографических методов диагностики.
Томск, SPIN-код: 7914-3111
Конфликт интересов:
отсутствует
В. В. Рябов
Россия
Доктор медицинских наук, руководитель отделения неотложной кардиологии.
Томск, SPIN-код: 5230-4887
Конфликт интересов:
отсутствует
К. В. Завадовский
Россия
Доктор медицинских наук, руководитель отдела лучевой диагностики
Томск, SPIN-код: 5081-3495
Конфликт интересов:
отсутствует
Дополнительные файлы
Рецензия
Для цитирования:
Мочула О.В., Сулейманова А.С., Сухарева А.Е., Рябов В.В., Завадовский К.В. Взаимосвязь степени повреждения миокарда по данным магнитно-резонансной томографии сердца с контрастированием и лабораторных данных у пациентов с острым инфарктом миокарда. Российский кардиологический журнал. 2022;27(11):5226. https://doi.org/10.15829/1560-4071-2022-5226
For citation:
Mochula O.V., Sulejmanova A.S., Sukhareva A.E., Ryabov V.V., Zavadovsky K.V. Relationship between the degree of myocardial damage according to contrast-enhanced cardiac magnetic resonance imaging and laboratory data in patients with acute myocardial infarction. Russian Journal of Cardiology. 2022;27(11):5226. (In Russ.) https://doi.org/10.15829/1560-4071-2022-5226

















































