Перейти к:
Клинический случай успешного транскатетерного протезирования аортального клапана у пациентки с аортальным стенозом, индуцированным лучевой терапией
https://doi.org/10.15829/1560-4071-2023-5220
Аннотация
Аортальный стеноз — одна из самых частых клапанных патологий сердца, встречающаяся у пациентов с онкологией после проведенной лучевой терапии и требующая оперативного лечения. Однако данная группа пациентов имеет более высокий риск развития интра- и послеоперационных осложнений, в связи с чем оптимальным методом хирургического лечения аортального стеноза у такой когорты больных является транскатетерная имплантация аортального клапана (TAVI).
Краткое описание. Молодая женщина 46 лет поступила в НМИЦ им. В. А. Алмазова с клинической картиной тяжелого аортального стеноза. В молодом возрасте у пациентки был диагностирован лимфогранулематоз, или болезнь Ходжкина, по поводу чего проводилась лучевая терапия, осложнившаяся в отдаленном периоде клапанной патологией. После тщательного обследования консилиумом сердечной команды был определен высокий интраоперационный риск и выполнена эндоваскулярная коррекция тяжелого аортального стеноза. Послеоперационный период осложнился развитием полной атриовентрикулярной блокады, послужившей причиной установки постоянного двухкамерного кардиостимулятора.
Дискуссия. Представленный клинический случай является примером успешного хирургического лечения у пациентки аортального стеноза, ассоциированного с ранее проводимой лучевой терапией по поводу болезни Ходжкина.
Заключение. Эндоваскулярная методика имплантации аортального клапана является многообещающим подходом к лечению пациентов с постлучевым аортальным стенозом, т.к. данная патология сопряжена с неблагоприятными анатомическими и клиническими факторами риска для хирургического протезирования клапана. Несмотря на более молодой возраст, данные пациенты представляют собой категорию более высокого хирургического риска, ввиду чего дополнительное внимание должно уделяться планированию процедуры и профилактике основных рисков TAVI.
Для цитирования:
Зубарев Д.Д., Сим С.В., Краснов В.С., Горбатых А.В., Чернявский М.А., Прохорихин А.А. Клинический случай успешного транскатетерного протезирования аортального клапана у пациентки с аортальным стенозом, индуцированным лучевой терапией. Российский кардиологический журнал. 2023;28(5):5220. https://doi.org/10.15829/1560-4071-2023-5220
For citation:
Zubarev D.D., Sim S.V., Krasnov V.S., Gorbatykh A.V., Chernyavsky M.A., Prokhorikhin A.A. Successful transcatheter aortic valve replacement in a patient with radiation-induced aortic stenosis. Russian Journal of Cardiology. 2023;28(5):5220. (In Russ.) https://doi.org/10.15829/1560-4071-2023-5220
-
Введение
На сегодняшний день лучевая терапия является эффективным методом лечения многих злокачественных заболеваний органов грудной клетки, что значительно увеличивает выживаемость данной когорты пациентов [1]. У более чем 80% ранее перенесших лучевую терапию диагностируется клапанная патология сердца, и наиболее часто проявляет себя стеноз (АС) аортального клапана (АК) [2]. Несмотря на превентивные меры (такие как снижение дозы радиации на область сердца, медикаментозная терапия), остается значительная доля пациентов, которым необходимо оперативное вмешательство [3]. К сожалению, широко использующиеся на сегодняшний день шкалы оценки хирургического риска не в полной мере отражают высокий риск открытого хирургического вмешательства у пациентов с лучевыми пороками сердца [4]. Транскатетерная имплантация АК (TAVI) является оправданной альтернативой ввиду меньшего интраоперационного риска, меньшей частоты осложнений в отдаленном периоде, а также риска смерти от открытого вмешательства [5][6].
-
Клинический случай
2.1. Информация о пациенте
В возрасте 6 лет у пациентки С. был диагностирован лимфогранулематоз шейных лимфоузлов, ввиду чего проводилась химио- и лучевая терапия. С 2019г отмечалось постепенное прогрессирование сердечной недостаточности, проявляющееся снижением толерантности к физической нагрузке, одышкой при подъеме на 3-4 этаж, ощущением "комка в горле" при физической нагрузке. Из сопутствующих заболеваний у пациентки отмечалось наличие артериальной гипертензии и пароксизмальной формы фибрилляции предсердий. В мае 2021г, в возрасте 46 лет, пациентка поступила в НМИЦ им. В. А. Алмазова для оперативного лечения тяжелого АС, индуцированного лучевой терапией.
2.2. Временная шкала
2.3. Диагностическая оценка
По данным эхокардиографии (ЭхоКГ) был диагностирован тяжелый АС (максимальная скорость 5,3 м/с, средний градиент давления 61 мм рт.ст., площадь АК 0,3 см2) с выраженным кальцинозом створок с переходом на фиброзное кольцо и распространенным кальцинозом восходящей дуги аорты. В покое нарушение сократительной функции не отмечалось (фракция выброса (ФВ) 82%, конечно-диастолический размер 34 мм, конечно-систолический размер 20 мм, конечно-диастолический объем 60 мл, конечно-систолический объем 16 мл, ударный объем 44 мл). По данным мультиспиральной компьютерной томографии-аортографии отмечалось наличие фиброзного кольца АК малого диаметра (16 мм) и низкое отхождение коронарных артерий (рис. 1, 2). Учитывая тяжесть АС, ухудшение клинического течения заболевания, пациентке рекомендовано протезирование АК. По данным стратификационных шкал был определен низкий хирургический риск — EuroSCORE II — 1,6%; STS — 3,4%. Однако выраженный кальциноз и малый диаметр (16 мм) фиброзного кольца, а также протяженный кальциноз восходящего отдела аорты исключили возможность хирургического протезирования АК, ввиду чего было решено выполнить транскатетерное протезирование.
2.4. Клинический диагноз
Неревматические поражения АК. Аортальный (клапанный) стеноз (I35.0).
2.5. Медицинские вмешательства
Операция выполнялась согласно стандартной методике через трансфеморальный доступ. В ходе процедуры была выполнена предилатация баллонным катетером, размером 16×40 мм, с одновременной аортографией для оценки возможной компрометации устьев коронарных артерий (рис. 3). Затем был позиционирован и имплантирован АК Medtronic Evolute R (диаметр 23 мм), с кровотоком по коронарному руслу на уровне TIMI III (рис. 4).
2.6. Динамика и исходы
В раннем послеоперационном периоде отмечалось возникновение персистирующей атриовентрикулярной (АВ) блокады, что потребовало имплантации двухкамерного постоянного электрокардиостимулятора через 5 дней после вмешательства. Неврологических нарушений не наблюдалось. Пациентка была выписана на 12 сут. в удовлетворительном состоянии. На контрольной ЭхоКГ отмечалась ФВ 56%, средний градиент давления на АК 12 мм рт.ст., аортальная регургитация 1 степени.
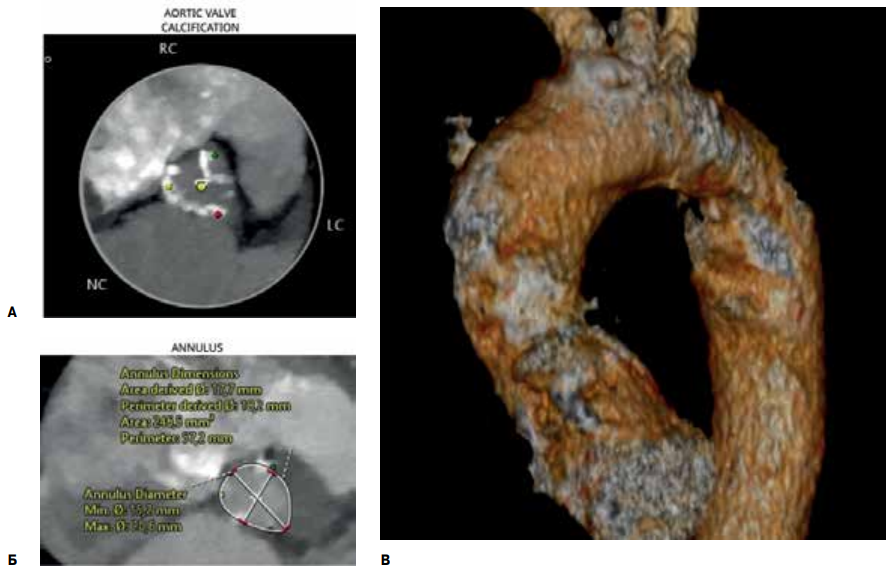
Рис. 1. Мультиспиральная компьютерная томография (А); кальциноз аортального клапана (Б); параметры фиброзного кольца аортального клапана; (В) кальциноз аорты.
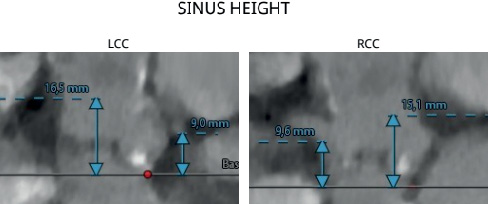
Рис. 2. Высота отхождения коронарных артерий (голубые стрелки).
Примечание: цветное изображение доступно в электронной версии журнала.
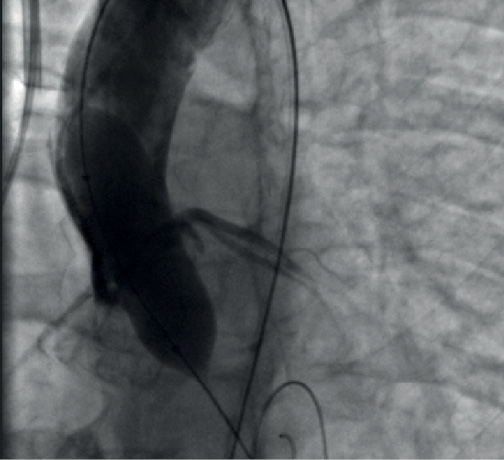
Рис. 3. Предилатация баллонным катетером с оценкой кровотока по коронарным артериям.
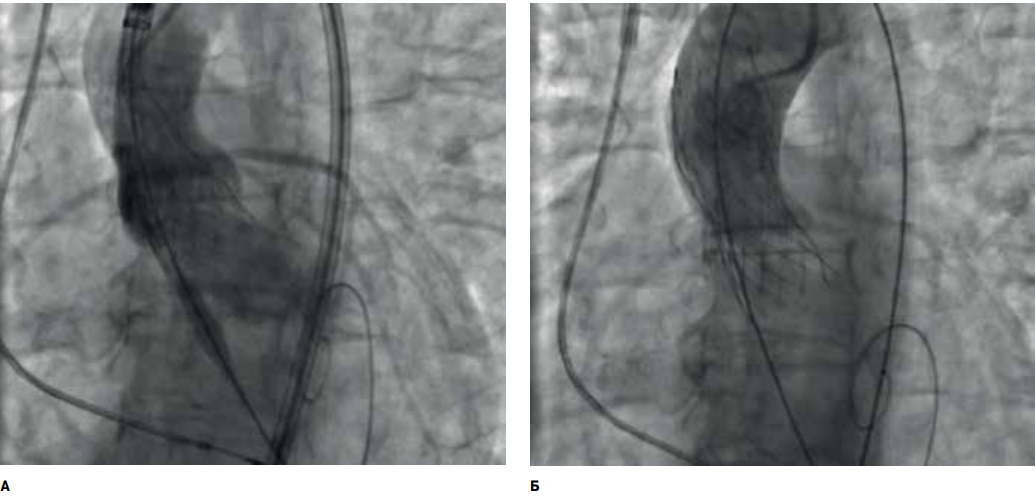
Рис. 4. Аортография до имплантации клапана (А); аортография после имплантации клапана (Б).
-
Обсуждение
Лучевая терапия является стандартным методом лечения агрессивных злокачественных новообразований, включая рак молочной железы, рак легких, Ходжкинскую лимфому и другие. К сожалению, подверженность лучевому облучению приводит к тяжелым клапанным порокам сердца, таким как АС. На сегодняшний день мы имеем ограниченное количество научных исследований о протезирования АК у больных после лучевой терапии. К таким примерам можно отнести работу Guedeney P, et al., в которой проанализировано 3675 таких пациентов, из которых 2170 (59,1%) перенесли TAVI и 1505 (40,9%) хирургическое протезирование [7]. Несмотря на исходную более высокий "индекс хрупкости" и наличие сопутствующих заболеваний (пожилой возраст, хроническое заболевание легких и почек), процедура TAVI продемонстрировала преимущество перед открытым вмешательством по таким показателям, как внутрибольничная летальность (отношение шансов (ОШ) 0,27, 95% доверительный интервал (ДИ): 0,09-0,79), дыхательные осложнения (ОШ 0,25, 95% ДИ: 0,08-0,75) и значимые кровотечения (ОШ 0,35, 95% ДИ: 0,24-0,51), показав при этом более высокий риск имплантации постоянного кардиостимулятора.
Также можно отметить результаты проведенного метаанализа, где Zafar MR, et al. сравнивали TAVI у пациентов без и с лучевой терапией в анамнезе [8]. Были получены сопоставимые результаты по летальности в течение 30 дней, однако в течение года смертность была выше у пациентов с лучевыми пороками. Это связано с тем, что, несмотря на более молодой возраст и меньший индекс хрупкости, такие пациенты на самом деле имеют больше факторов риска. Так, у пациентов после лучевой и химиотерапии часто встречаются слабое функциональное состояние (индекс Катц <6), атеросклероз и кальциноз аорты, фиброз средостения и проводящих путей сердца [9]. Ввиду последнего, пациенты с лучевыми пороками изначально имеют повышенный риск АВ-блокад высокой степени при выполнении TAVI. Это происходит в результате непосредственной близости АК и проводящей системы сердца [10]. АВ-узел расположен рядом с пучком Гиса, проходящим по нижнему краю мембранозной части межжелудочковой перегородки. Оценка длины данной части перегородки служит дополнительным ориентиром при позиционировании клапана [11].
Добиться более точной высокой имплантации протеза можно в проекции "cusp overlap view", которая заключается в наложении левого и правого коронарных синусов, и изоляции некоронарного синуса и позволяет минимизировать взаимодействие с проводящей системой. Однако в нашем случае, в связи с высоким риском миграции протеза в восходящую аорту из-за малого размера фиброзного кольца АК, высокая имплантация протеза не планировалась, поэтому применение представленной выше методики не было целесообразным.
В послеоперационном периоде по данным ЭхоКГ на себя обращали внимание высокий остаточный градиент на протезе (12 мм рт.ст.) и снижение ФВ с 82% до 56%. Снижение ФВ вероятнее всего стало проявлением совокупности терапии бета-блокаторами и началом электрокардиостимуляции. Относительно высокий остаточный средний градиент давления обусловлен малой анатомией корня аорты и его выраженным кальцинозом. Тем не менее данные показатели не нашли отражения в клиническом состоянии пациентки.
Важно отметить, что на госпитальном этапе по данным компьютерной томографии-ангиографии был выявлен тяжелый кальциноз восходящей аорты. Частота встречаемости данного осложнения после лучевой терапии составляет ~13%, а также у 20% пациентов, которым выполняется TAVI [12]. Фарфоровая аорта является крайне неблагоприятным фактором, увеличивающим риск инсульта во время открытой хирургической операции. Однако данный фактор, как и ряд других, не отражен в наиболее часто применяемых хирургических шкалах риска, таких как Euroscore II и STS, что еще раз подчеркивает тот факт, что тяжесть вмешательств у пациентов с лучевыми пороками зачастую может быть недооценена.
Представленный клинический случай интересен тем, что несмотря на сопряженные с интервенционным вмешательством риски удалось успешно устранить тяжелый АС у молодой пациентки с высоким хирургическим риском, перенесшей в прошлом лучевую терапию.
-
Заключение
Эндоваскулярная методика имплантации АК является многообещающим подходом к лечению пациентов с постлучевым АС, т.к. данная патология сопряжена с неблагоприятными анатомическими и клиническими факторами риска для хирургического протезирования клапана. Несмотря на более молодой возраст, данные пациенты представляют собой категорию более высокого хирургического риска, ввиду чего дополнительное внимание должно уделяться планированию процедуры и профилактике основных рисков TAVI.
-
Прогноз для пациента
Можно предположить, что успешно проведенное TAVI будет способствовать регрессу клинических симптомов, беспокоящих пациентку, несмотря на нарушение ритма сердца, возникшее в раннем послеоперационном периоде и потребовавшее имплантации постоянного электрокардиостимулятора.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Список литературы
1. Cutter DJ, Schaapveld M, Darby SC, et al. Risk of valvular heart disease after treatment for Hodgkin lymphoma. Journal of the National Cancer Institute. 2015;107(4):1-9. doi:10.1093/jnci/djv008.
2. Tamura A, Takahara Y, Mogi K, et al. Radiation-induced valvular disease is the logical consequence of irradiation. Gen Thorac Cardiovasc Surg. 2007;55(2):53-6. doi:10.1007/s11748-006-0070-x.
3. Wang H, Wei J, Zheng Q, et al. Radiation-induced heart disease: a review of clas¬sification, mechanism and prevention. International Journal of Biological Sciences. 2019;15(10):2128-38. doi:10.7150/ijbs.35460.
4. Corrigendum to: 2021 ESC/EACTS Guidelines for the management of valvular heart disease: Developed by the Task Force for the management of valvular heart disease of the European Society of Cardiology (ESC) and the European Association for Cardio-Thoracic Surgery (EACTS). European Heart Journal. 2022;43(21):2022. doi:10.1093/eurheartj/ehac051.
5. Copeland KA, Hosmane VR, Jurkovitz C, et al. Frequency of severe valvular disease cau¬sed by mediastinal radiation among patients undergoing valve surgery in a com¬mu¬nity-based, regional academic medical center. Clin Cardiol. 2013;36(4):217-21. doi:10.1002/clc.22106.
6. Donnellan E, Masri A, Johnston DR, et al. Long-Term Outcomes of Patients With Media¬stinal Radiation-Associated Severe Aortic Stenosis and Subsequent Surgical Aortic Valve Replacement: A Matched Cohort Study. J Am Heart Assoc. 2017;6(5):1-11. doi:10.1161/JAHA.116.005396.
7. Guedeney P, Collet JP. TAVR: A Dazzling Alternative to SAVR for Patients With Prior Mediastinal Radiation. JACC Cardiovasc Interv. 2020;13(22):2667-9. doi:10.1016/j.jcin.2020.09.025.
8. Zafar MR, Mustafa SF, Miller TW, et al. Outcomes after transcatheter aortic valve replace¬ment in cancer survivors with prior chest radiation therapy: a systematic review and meta-analysis. Cardiooncology. 2020;6:8. doi:10.1186/s40959-020-00062-y.
9. Kamenskaya O, Loginova I, Kretov E, et al. Effect of transcatheter aortic valve implan¬tation on health-related quality of life in older adults with multimorbidity. Archives of geron¬tology and geriatrics. 2019;80:76-81. doi:10.1016/j.archger.2018.10.007.
10. Siontis GCM, Juni P, Pilgrim T, et al. Predictors of permanent pacemaker implantation in patients with severe aortic stenosis undergoing TAVR: a meta-analysis. J Am Coll Cardiol. 2014;64:129-40. doi:10.1016/j.jacc.2014.04.033.
11. Jilaihawi H, Zhao Z, Du R, et al. Minimizing Permanent Pacemaker Following Repositio¬nable Self-Expanding Transcatheter Aortic Valve Replacement. JACC Cardiovasc. Interv. 2019;12:1796-807. doi:10.1016/j.jcin.2019.05.056.
12. Abramowitz Y, Jilaihawi H, Chakravarty T, et al. Porcelain aorta: a comprehensive review. Circulation. 2015;131(9):827-6. doi:10.1161/CIRCULATIONAHA.114.011867.
Об авторах
Д. Д. ЗубаревРоссия
Кандидат медицинских наук, зав. отделением рентгенохирургических методов диагностики и лечения
Санкт-Петербург
С. В. Сим
Россия
Клинический ординатор отделения рентгенохирургических методов диагностики и лечения
Санкт-Петербург
В. С. Краснов
Россия
Врач по рентгенэндоваскулярным диагностике и лечению
Санкт-Петербург
А. В. Горбатых
Россия
Кандидат медицинских наук, зав. НИЛ интервенционной и эндоваскулярной хирургии, старший научный сотрудник, врач по рентгенэндоваскулярным диагностике и лечению
Санкт-Петербург
М. А. Чернявский
Россия
Доктор медицинских наук, зав. НИО сосудистой и интервенционной хирургии, главный научный сотрудник, сердечно-сосудистый хирург
Санкт-Петербург
А. А. Прохорихин
Россия
Прохорихин Алексей Андреевич — кандидат медицинских наук, врач по рентгенэндоваскулярным диагностике и лечению
Санкт-Петербург
Дополнительные файлы
Рецензия
Для цитирования:
Зубарев Д.Д., Сим С.В., Краснов В.С., Горбатых А.В., Чернявский М.А., Прохорихин А.А. Клинический случай успешного транскатетерного протезирования аортального клапана у пациентки с аортальным стенозом, индуцированным лучевой терапией. Российский кардиологический журнал. 2023;28(5):5220. https://doi.org/10.15829/1560-4071-2023-5220
For citation:
Zubarev D.D., Sim S.V., Krasnov V.S., Gorbatykh A.V., Chernyavsky M.A., Prokhorikhin A.A. Successful transcatheter aortic valve replacement in a patient with radiation-induced aortic stenosis. Russian Journal of Cardiology. 2023;28(5):5220. (In Russ.) https://doi.org/10.15829/1560-4071-2023-5220

















































