Перейти к:
Электрокардиографические признаки нарушения процессов деполяризации (фрагментация QRS-комплекса, феномен ранней реполяризации желудочков и др.) как маркеры систолической дисфункции левого желудочка
https://doi.org/10.15829/1560-4071-2022-5113
Аннотация
Цель. Изучить взаимосвязь снижения фракции выброса (ФВ) левого желудочка (ЛЖ) с традиционными электрокардиографическими (ЭКГ)признаками, ассоциированными со структурными изменениями миокарда (патологический зубец Q, желудочковые нарушения ритма), и относительно новыми и менее изученными (фрагментация QRS-комплекса (fQRS), феномен ранней реполяризации желудочков (ФРРЖ)) и оценить их значимость для выявления пациентов с промежуточным снижением ФВ (пФВ).
Материал и методы. В исследование включено 148 пациентов, проходивших лечение и обследование в НМИЦ им. В. А. Алмазова. При анализе ЭКГ описывались fQRS, ФРРЖ, патологический зубец Q, желудочковые нарушения ритма (ЖНР). Были проанализированы результаты эхокардиографии, проведен статистический анализ данных: тест по критерию Фишера и хиквадрат, корреляционный анализ и ROC-анализ.
Результаты. По уровню ФВ пациенты были разделены на три группы: 1 группа — пациенты с низкой ФВ (нФВ) (<40%); 2 группа — пациенты с пФВ (4049%); 3 группа — пациенты с сохранной ФВ (сФВ) (>50%). В 1-ой группе fQRS зарегистрирована у 16 (51,6%) пациентов, во 2-ой — у 13 (44,8%), в 3-ей — у 16 (18,2%). Патологический зубец Q был выявлен в 1-ой группе у 20 (65%), во 2-ой у 10 (35%); в 3-ей у 15 (18%) (p<0,001). По данным ROC-анализа установлено, что fQRS имеет большее значение для выявления пациентов с пФВ. В 1-ой группе ФРРЖ зарегистрирован у 2 (6,5%) пациентов, во 2-ой — у 2 (6,9%), в 3-ей — у 11 (12,5%), различия статистически недостоверны (p=0,5). Взаимосвязи ФРРЖ, количества ЖЭК и наличия желудочковой тахикардии с ФВ выявлено не было.
Заключение. fQRS достоверно чаще наблюдается при снижении ФВ и может быть маркером пФВ. Статистически значимых корреляций между ФРРЖ и ФВ выявлено не было. Также не было выявлено взаимосвязи между ЖНР и систолической дисфункцией ЛЖ.
Ключевые слова
Для цитирования:
Гордеева М.С., Сердюкова И.А., Красичков А.С., Пармон Е.В. Электрокардиографические признаки нарушения процессов деполяризации (фрагментация QRS-комплекса, феномен ранней реполяризации желудочков и др.) как маркеры систолической дисфункции левого желудочка. Российский кардиологический журнал. 2022;27(7):5113. https://doi.org/10.15829/1560-4071-2022-5113
For citation:
Gordeeva M.S., Serdiukova I.A., Krasichkov A.S., Parmon E.V. Electrocardiographic signs of impaired depolarization (fragmented QRS, early ventricular repolarization, etc.) as markers of left ventricular systolic dysfunction. Russian Journal of Cardiology. 2022;27(7):5113. (In Russ.) https://doi.org/10.15829/1560-4071-2022-5113
В 1997г Е. Браунвальд назвал хроническую сердечную недостаточность (ХСН) новой эпидемией [1]. В последние 20 лет, несмотря на значительные успехи в ее лечении, количество таких пациентов в общей популяции остается высоким (8,2% в России по данным исследования ЭПОХА-ХСН [2]) и продолжает увеличиваться. ХСН также является одной из наиболее частых причин госпитализаций и вносит существенный вклад в структуру летальности [3]. Крайне важной и до конца не решенной задачей является выявление пациентов с ХСН, особенно на ранних стадиях [4, 5].
Одним из основных критериев диагностики ХСН считается показатель фракции выброса (ФВ) левого желудочка (ЛЖ), которая определяет дальнейшую тактику ведения пациента. Долгое время значимо низкой считалась ФВ ЛЖ <40% (нФВ), однако в 2016г Европейское общество кардиологов предложило выделять группу пациентов с промежуточным снижением ФВ ЛЖ (пФВ) — 40-49% [6]. В настоящее время именно этой группе уделяется большое внимание. Так, в исследованиях была продемонстрирована актуальность выявления и раннего начала лечения ХСН с пФВ [7-11]. Однако клинические проявления ХСН у таких пациентов значительно менее выражены, что осложняет своевременную диагностику и лечение.
Ведущим методом диагностики ХСН и оценки ФВ ЛЖ является эхокардиография (ЭхоКГ). Тем не менее этот метод не является первичным при скрининговом обследовании пациентов как в общей популяции, так и среди больных с известными заболеваниями сердца. Самым распространенным методом обследования сердечно-сосудистой системы у всех групп пациентов остается электрокардиография (ЭКГ). Однако ЭКГ-признаки, наблюдаемые при снижении ФВ ЛЖ (увеличение продолжительности QRS-комплекса, интервалов PR, QT, блокады ножек пучка Гиса), а также другие паттерны структурных изменений миокарда, потенциально ассоциированные со снижением ФВ ЛЖ (патологический зубец Q, признаки гипертрофии ЛЖ, замедленное нарастание зубца R в грудных отведениях и др.), не являются специфичными [12-17].
Существует ряд исследований, в которых изучалась диагностическая точность ЭКГ как метода, позволяющего предположить снижение ФВ ЛЖ. Так, в метаанализе Khunti K, et al. (2004) была показана низкая диагностическая точность ЭКГ в выявлении снижения ФВ ЛЖ (чувствительность от 73% до 94%, а специфичность от 20% до 65%). В данном исследовании учитывались такие традиционные неспецифические признаки, как блокады ножек пучка Гиса, продолжительность QRS-комплекса, признаки перенесенного инфаркта миокарда, замедленное нарастание зубца R в грудных отведениях, признаки гипертрофии ЛЖ [18]. Стоит отметить, что в большинстве работ, посвященных изучению ЭКГ как метода скринингового выявления сниженной ФВ ЛЖ, предметом изучения была ФВ ЛЖ <40%. Выявление пФП посредством ЭКГ представляется еще более сложной задачей. В настоящее время активно ведутся поиски новых ЭКГ-признаков и подходов (разработка индексов, использование искусственного интеллекта) для диагностики сердечной недостаточности, в т.ч. с пФВ или сохранной ФВ (сФВ) ЛЖ, изучаются такие показатели, как дисперсия интервалов PR и QT, отношение Tpeak/Tend, QRS-T-угол и другие [19].
Важнейшим фактором возникновения и прогрессирования систолической дисфункции ЛЖ является фиброз миокарда. Известно, что и очаговый, и интерстициальный фиброз в первую очередь приводят к нарушению процессов деполяризации миокарда [20]. Поэтому именно ЭКГ-признаки, отражающие нарушения процессов деполяризации, в частности — фрагментация QRS-комплекса (fQRS), феномен ранней реполяризации желудочков (ФРРЖ), а также желудочковые эктопические комплексы (ЖЭК), являются наиболее перспективными ЭКГ-признаками для выявления снижения ФВ [21].
Связь fQRS с фиброзом миокарда была доказана в ряде исследований [22-24]. Продемонстрирована риск-стратификационная значимость этого ЭКГпризнака у пациентов с различной патологией сердечно-сосудистой системы при: ИБС [25-29], гипертрофической кардиомиопатии [30][31], синдроме Бругада [32], ХСН с нФВ ЛЖ [33]. Взаимосвязь между fQRS и систолической дисфункцией миокарда изучена меньше. Известно, что у пациентов с хронической болезнью почек fQRS в нижних отведениях ассоциирована со снижением ФВ ЛЖ [34]. В исследованиях Nikoo M, et al. (2020) и Bayramoğlu A, et al. (2019г) было показано, что fQRS может быть предиктором снижения ФВ ЛЖ у здоровых лиц [35][36]. Наличие ФРРЖ также продемонстрировало взаимосвязь со структурными изменениями миокарда и с толщиной стенки ЛЖ [37-39]. Обнаружена высокая риск-стратификационная значимость ФРРЖ у пациентов со структурными изменениями миокарда различного генеза [40] как в общей популяции [41], так и при ХСН [42]. Однако взаимосвязь этого ЭКГ-признака со снижением ФВ ЛЖ изучена недостаточно.
Таким образом, представляется перспективным изучение fQRS и ФРРЖ в контексте первичного скрининга снижения ФВ ЛЖ.
Целью нашего исследования было изучить взаимосвязь снижения ФВ с традиционными ЭКГпризнаками, ассоциированными со структурными изменениями миокарда (патологический зубец Q, продолжительность QRS-комплекса, желудочковые нарушения ритма (ЖНР)) и относительно новыми и менее изученными ЭКГ-признаками нарушения процессов деполяризации (fQRS, ФРРЖ) и оценить их предсказательную способность для выявления пациентов с пФВ.
Материал и методы
В исследование включено 148 пациентов, проходивших лечение и обследование в связи с различными структурными изменениями миокарда ишемического и неишемического генеза. Ретроспективно были проанализированы данные анамнеза, кардиовизуализирующих методов обследования (ЭхоКГ, магнитно-резонансной томографии (МРТ), однофотонной эмиссионной компьютерной томографии (ОФЭКТ)), ЭКГ, холтеровского мониторирования ЭКГ (ХМ-ЭКГ).
Исследование выполнено в рамках крупного научного проекта “Разработка новых технологий профилактики и лечения сердечной недостаточности на основе нейромодуляции”, соглашение № 075-15-2020-800 от 24.09.2020г ФГБУ НМИЦ им. В.А. Алмазова с Министерством науки и высшего образования Российской Федерации. Исследование было выполнено в соответствии со стандартами надлежащей клинической практики (Good Clinical Practice) и принципами Хельсинкской декларации.
У всех пациентов были проанализированы результаты ХМ-ЭКГ и ЭКГ в 12 отведениях при стандартных настройках (12-канальная запись ЭКГ: фильтр высоких частот: 0,05-20 Гц, фильтр низких частот: 100-150 Гц, скорость бумаги: 25-50 мм/с, амплитуда: 10 мм/мВ). Анализ ЭКГ проводился двумя исследователями независимо друг от друга. В случае расхождения полученных результатов решение принималось коллегиально с привлечением третьего исследователя. Для fQRS использовались критерии Das M, et al., в соответствии с которыми фрагментацией в узких комплексах считалось наличие двух и более зазубрин на зубцах R или S как минимум в двух смежных отведениях, а в широких (>120 мс) — наличие двух зазубрин, расстояние между которыми превышает 40 мс или наличие трех и более зазубрин на зубцах R или S как минимум в двух смежных отведениях. [43]. Критериями для ФРРЖ были наличие волны или зазубрины QRS-комплекса на нисходящем колене зубца R выше изолинии. Пик J должен быть ≥0,1 mV в двух или более смежных отведениях, за исключением отведений с V1-V3. Оценка ФРРЖ проводилась только в узких комплексах (<120 мс) [44]. Для ФРРЖ и fQRS оценивалась локализация выявленных изменений: передней стенке ЛЖ соответствовали изменения, зарегистрированные в отведениях V1-V3, боковой стенке — в отведениях I, aVL и V6, нижней стенке — в отведениях II, III, и aVF. Кроме того, по ЭКГ оценивалась максимальная продолжительность QRS-комплекса, наличие патологического зубца Q. По результатам ХМ-ЭКГ оценивали количество ЖЭК, наличие желудочковой тахикардии (ЖТ).
У всех пациентов были проанализированы результаты ЭхоКГ, выполнявшейся на приборах VIVID 7 Dimension (General Electric, США) по стандартному протоколу в соответствии с рекомендациями Европейского общества по ЭхоКГ. Анализировались параметры, отражающие систолическую функцию ЛЖ, такие как конечно-диастолический размер (КДР) ЛЖ, конечно-систолический размер (КСР) ЛЖ, ФВ ЛЖ (по Simpson), конечно-систолический объем (КСО) ЛЖ, конечно-диастолический объем (КДО) ЛЖ, а также толщина межжелудочковой перегородки (МЖП).
Статистический анализ. Первоначально в работе проведен поисковый анализ категориальных и количественных переменных базы данных для группировки пациентов по ФВ, построение математической модели и расчет характеристик вариационного ряда: математическое ожидание, дисперсия, стандартное отклонение, коэффициенты вариации, асимметрия, эксцесс и другие статистические данные, а также был проведен гэп-анализ. Анализ количественных переменных проводился с использованием однофакторного дисперсионного метода. Далее для количественных переменных анализировали распределение по одностороннему критерию Колмогорова-Смирнова. С помощью критерия Колмогорова-Смирнова распределения проверялись на нормальность. Для выбранных количественных переменных установление взаимодействия с целевой переменной осуществлялось непараметрическими методами по критерию Манна-Уитни. После этого анализа были выбраны количественные переменные, которые являются потенциальными предикторами. Для номинальных переменных корреляцию с целевой переменной проверяли с помощью критерия хи-квадрат и критерия Фишера. На основе этих критериев потенциальные предикторы определены из номинальных переменных. Следующим шагом в статистическом анализе было построение модели логистической регрессии.
Были построены и проанализированы четыре модели: пошаговый метод исключения предикторов и пошаговый метод включения предикторов, каждая из которых рассматривалась с постоянным включением и без него. В результате наибольшую значимость показала модель, построенная методом последовательного включения. Этот вариант модели был выбран для построения методом принудительного включения. Качество построенной модели определялось коэффициентами Найджелкерка.
В работе также с помощью ROC-кривых проанализировано влияние наличия патологического зубца Q и отведений, в которых регистрировалась fQRS в группе с пФВ.
Результаты
По уровню ФВ по данным ЭхоКГ пациенты были разделены на три группы: 1 группа — пациенты с нФВ (<40%): всего 31 (25 мужчин, средний возраст 52,0±15,6); 2 группа — пациенты с пФВ (40-49%): всего 29 (23 мужчины, средний возраст 54,7±12,4); 3 группа — пациенты сФВ (>50%): всего 88 (57 мужчин, средний возраст 58,2±12,0) — группа контроля.
В группе пациентов сФВ фиброзные (рубцовые постинфарктные и постмиокардитические) изменения регистрировались достоверно реже (p<0,001), в то время как встречаемость таких структурных изменений у пациентов с пФВ и нФВ не имела статистически значимых различий (рис. 1).
В 1-ой группе (у пациентов с нФВ) fQRS зарегистрирована у 16 (51,6%) пациентов, во 2-ой (у пациентов с пФВ) — у 13 (44,8%), в 3-ей (c ФВ >50%) — у 16 (18,2%). На рисунке 2 продемонстрировано распределение количества наблюдений для параметра fQRS в исследуемых группах. Сравнение показателей проводилось по критерию χ2, различия являются статистически достоверными (p<0,001). На рисунке 3 представлены гистограммы распределения ФВ относительно значений переменной fQRS, которые позволяют детально оценить количество наблюдений для каждого значения ФВ. Результат является статистически достоверным (p<0,001).
На рисунке 4 представлен пример ЭКГ с fQRS в отведениях III и aVF у пациентки Г., 37 лет, с пФВ (43%), без рубцовых изменений миокарда по данным ЭхоКГ и МРТ.
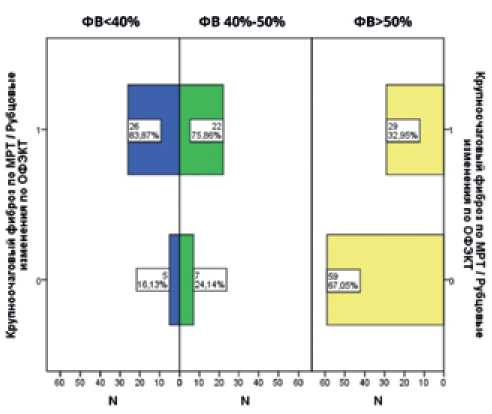
Рис. 1. Встречаемость рубцовых изменений по данным кардиовизуализирующих (МРТ, ОФЭКТ) методов исследования.
Примечание: 0 — рубцовые изменения отсутствуют, 1 — рубцовые изменения присутствуют.
Сокращения: МРТ — магнитно-резонансная томография, ОФЭКТ — однофотонная эмиссионная компьютерная томография, ФВ — фракция выброса, N — количество наблюдений.
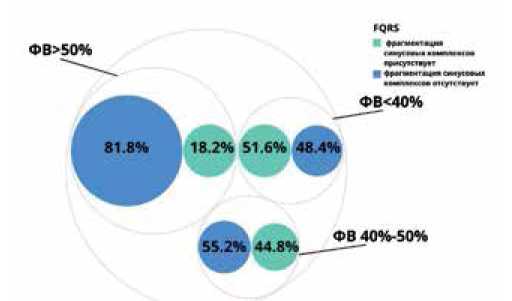
Рис. 2. Встречаемость fQRS в исследуемых группах.
Сокращения: ФВ — фракция выброса, fQRS — фрагментация QRS-комплекса.

Рис. 3. Взаимосвязь между ФВ и наличием fQRS.
Примечание: 0 — рубцовые изменения отсутствуют, 1 — рубцовые изменения присутствуют.
Сокращения: ФВ — фракция выброса, fQRS — фрагментация QRS-комплекса, N — количество наблюдений.

Рис. 4. Пример ЭКГ с fQRS у пациентки с пФВ.
Примечание: fQRS в отведениях III, aVF, патологический зубец Q не зарегистрирован, QRS-комплекс не расширен.
Во всех группах были проанализированы отведения ЭКГ, в которых зарегистрировалась fQRS. Для первой группы пациентов было характерно наличие fQRS в отведениях ЭКГ передней стенки ЛЖ, для второй группы пациентов боковой стенки ЛЖ и для третьей группы нижней стенки ЛЖ. Результаты представлены в таблице 1.
Была проанализирована взаимосвязь между fQRS и такими показателями систолической функции миокарда, как ФВ, КДО, КСО, КДР, КСР, толщиной МЖП. Результаты представлены в таблице 2.
Была обнаружена слабая прямая взаимосвязь между fQRS и КДО, КСО, КСР, КЖР и ФВ. На рисунке 5 показана взаимосвязь между fQRS и КСО. У пациентов без выявленной fQRS показатель КСО наблюдается в диапазоне 20-80 мл. У пациентов с fQRS показатель КСО находится в диапазоне 40-80 мл. Сравнение показателей проводилось по критерию U Манна-Уитни, различия являются статистически достоверными (p<0,001).
Патологический зубец Q был выявлен в первой группе (нФВ) у 20 (65%) пациентов, во второй группе (пФВ) у 10 (35%); в третьей группе (ФВ >50%) у 15 (18%) пациентов. Сравнение показателей проводилось по критерию χ2, различия являются статистически достоверными (p<0,001) (рис. 6).
У пациентов с пФВ установлена взаимосвязь с наличием fQRS и отведениями, в которых она регистрировалась (выделено серым), с остальными параметрами взаимосвязи обнаружено не было (табл. 3).
Таблица 1
Распределение пациентов в исследуемых группах в зависимости от локализации изменений по отведениям, в которых регистрировалась fQRS

Примечание: сравнение показателей проводилось по критерию χ2, различия не являются статистически достоверными (p=0,5).
Сокращение: ЛЖ — левый желудочек.
Таблица 2
Таблица корреляций показателей систолической функции миокарда и fQRS

Примечание: слабая взаимосвязь — коэффициент корреляции <0,5, сильная >0,75.
Сокращения: КДО — конечно-диастолический объем, КДР — конечно-диастолический размер, КСО — конечно-систолический объем, КСР — конечно-систолический размер, МЖП — толщина межжелудочковой перегородки, ФВ — фракция выброса, N — число наблюдений.
Таблица 3
Взаимосвязь изучаемых ЭКГ-признаков с пФВ (40-49%)
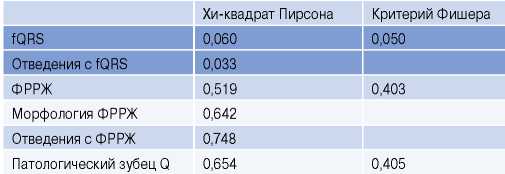
Сокращения: ФРРЖ — феномен ранней реполяризации желудочков, fQRS — фрагментация QRS-комплекса.
В результате оценки графика ROC-кривых было выявлено, что fQRS имеет большее значение для выявления пациентов с пФВ по сравнению с зубцом Q у пациентов с пФВ (рис. 7).
У пациентов с нФВ по результатам проведенного ROC-анализа наибольшей предсказательной способностью обладает зубец Q, а не fQRS (рис. 8).

Рис. 5. Взаимосвязь между переменными fQRS и конечным систолическим объемом.
Примечание: 0 — рубцовые изменения отсутствуют, 1 — рубцовые изменения присутствуют.
Сокращения: КСО — конечный систолический объем, ФВ — фракция выброса, fQRS — фрагментация QRS-комплекса, N — количество наблюдений.
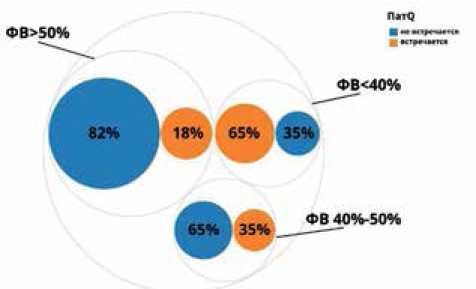
Рис. 6. Встречаемость патологического зубца Q в исследуемых группах.
Сокращения: ФВ — фракция выброса, ПатQ — патологический зубец Q.

Рис. 7. ROC-кривые для патологического зубца Q и fQRS у пациентов с пФВ.
Сокращения: fQRS — фрагментация QRS-комплекса, Qпат — патологический зубец Q.

Рис. 8. ROC-кривые для патологического зубца Q и fQRS у пациентов с пФВ.
Сокращения: fQRS — фрагментация QRS-комплекса, Qпат — патологический зубец Q.

Рис. 9. Различие групп по продолжительности QRS-комплекса.
Сокращения: ФВ — фракция выброса, N — количество наблюдений.
Была проанализирована встречаемость ФРРЖ в исследуемых группах. ФРРЖ был проанализирован у всех пациентов с комплексом QRS <120 мс.
В 1 группе (нФВ) ФРРЖ зарегистрирован у 2 (6,5%) пациентов, во 2 группе (пФВ) — у 2 (6,9%), в 3 группе (ФВ >50%) — ФРРЖ зарегистрирован у 11 (12,5%) пациентов. Сравнение показателей проводилось по критерию χ2, различия не являются статистически достоверными (p=0,5).
Изучалась встречаемость ФРРЖ в зависимости от ФВ, взаимосвязь между ФРРЖ и ФВ с помощью анализа корреляции p-Спирмена не была установлена, коэффициент корреляции =0,155. Результаты представлены в таблице 4.
Во всех группах был проведен анализ отведений ЭКГ, в которых был зарегистрирован ФРРЖ.
Также были проанализированы различия морфологии ФРРЖ (волна или зазубрина), в зависимости от исследуемой группы. В 1 группе у 1 (50%) пациента выявлялась ФРРЖ с зазубриной, у 1 (50%) — с волной. Во 2 группе у 1 (50%) пациента — зазубрина, у 1 (50%) — волна. В 3 группе у 2 (18,2%) пациентов — зубец, у 9 (81,8%) — волна, различия в группах не были статистически достоверны.
Была изучена взаимосвязь между показателями ФВ, КДО, КСО, КДР, КСР, толщина МЖП и ФРРЖ. Значимых корреляций обнаружено не было.
Проведен анализ распределения пациентов в исследуемых группах в зависимости от продолжительности QRS-комплекса (рис. 9). Продолжительность QRS имеет обратную зависимость от ФВ, что следует из среднего значения (мс) и доверительного интервала. Результаты представлены в таблице 5. У 23 пациентов ширина комплекса QRS превышала 120 мс. В группе с сФВ — у 7 обследованных, с пФВ — у 8 обследованных, с нФВ — у 8.
Среднее количество ЖЭК у пациентов в исследовании составило 2685,16 в сут., а среднеквадратичное отклонение — 7119, это означает, что между пациентами существует большой разброс значений ЖЭК — от 0 до 36721. Не было выявлено взаимосвязи между количеством ЖЭК и ФВ (коэффициент корреляции =-0,058). Результат является статистически достоверным (p=0,16).
В результате корреляционного анализа взаимосвязи между ФВ и ЖТ не обнаружено, коэффициент корреляции =-0,251. Анализ с использованием ROCкривой также не показал достоверных результатов.
Для удобства визуального представления полученной информации по трём группам, далее представлена сводная таблица 6.
Таблица 4
Распределение пациентов в исследуемых группах в зависимости от ЭКГ-отведений регистрации ФРРЖ

Примечание: сравнение показателей проводилось по критерию χ2, различия не являются статистически достоверными (p=0,7).
Сокращение: ЛЖ — левый желудочек.
Таблица 5
Распределение пациентов в исследуемых группах в зависимости от продолжительности QRS-комплекса
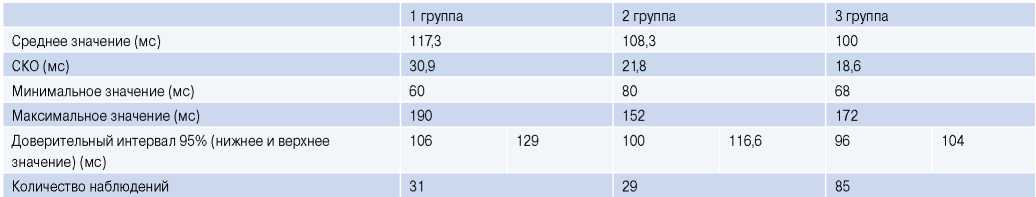
Примечание: сравнение показателей проводилось по критерию U Манна-Уитни, различия являются статистически достоверными (p=0,004).
Сокращение: СКО — среднеквадратичное отклонение.
Таблица 6
Сводная информация по трём группам ФВ

Сокращения: ЛЖ — левый желудочек, СКО — среднеквадратичное отклонение, ФРРЖ — феномен ранней реполяризации желудочков, fQRS — фрагментация QRS-комплекса.
В целом в исследовании был проведен анализ взаимосвязи ЭКГ-признаков, отражающих нарушения процессов деполяризации и параметров, характеризующих дисфункцию ЛЖ. Статистический анализ fQRS в исследуемых группах выявил, что у пациентов с сФВ данный ЭКГ-признак, как правило, отсутствует. Установлено, что у 62,5% (10) пациентов fQRS зарегистрированы в отведениях, соответствующих нижней стенке ЛЖ. Статистический анализ ФРРЖ в исследуемых группах показал близкие значения для групп с нФВ и пФВ, у большинства пациентов ФРРЖ отсутствовал. Патологический зубец Q чаще регистрировался у пациентов с нФВ (1 группа). Чтобы проверить, можно ли предсказать потенциальное попадание пациентов в группу с пФВ, была использована модель логистической регрессии. В результате проведенного анализа было установлено, что наибольшее прогностическое значение для выявления пациентов с пФВ имеет fQRS.
Таким образом, fQRS достоверно чаще наблюдался при снижении ФВ — как в группе с пФВ, так и с нФВ. Такая же зависимость была характерна для патологического зубца Q, и для увеличенной продолжительности QRS-комплекса. Но именно fQRS в целом оказалась более показательным маркером, чем патологический зубец Q в отношении выявления снижения ФВ. Гораздо реже у пациентов в исследуемых группах наблюдался ФРРЖ, статистически значимых корреляций между ним и ФВ выявлено не было, также не было выявлено взаимосвязи между ЖНР и систолической дисфункцией ЛЖ.
Обсуждение
В данной работе мы анализировали взаимосвязь снижения ФВ как с традиционными ЭКГпризнаками, ассоциированными со структурными изменениями миокарда (патологический зубец Q, продолжительность QRS-комплекса, ЖНР), так и относительно новыми и менее изученными (fQRS, ФРРЖ).
В нашем исследовании патологический зубец Q чаще регистрировался в группе пациентов с нФВ (почти в 2 раза чаще, чем у пациентов с пФВ), что согласуется с данными ряда работ, где также была продемонстрирована связь этого ЭКГ-признака со снижением ФВ <40% [45][46]. Наличие патологического зубца Q на ЭКГ, как правило, указывает на имеющиеся рубцовые изменения миокарда. Со структурными изменениями миокарда также связано и увеличение продолжительности QRS-комплекса, и по данным литературы, QRS >120 мс у пациентов со снижением ФВ встречается у 14-47% пациентов [47]. В нашем исследовании также наибольшая продолжительность QRS-комплекса была выявлена среди пациентов с ФВ <40% и >110 мс. При этом как у пациентов с пФВ, так и у пациентов с сФВ продолжительность QRS-комплекса наиболее часто была в диапазоне от 80 мс до 100 мс. Таким образом, ни наличие патологического зубца Q, ни продолжительность QRS-комплекса не позволили нам выделить группу пациентов с пФВ.
ЖНР (ЖЭК, ЖТ) хоть и не являются ЭКГ-признаками, указывающими на структурные изменения миокарда и снижение ФВ, однако часто рассматриваются именно во взаимосвязи с ХСН как проявление измененной деполяризации, связанной с фиброзом миокарда [48]. Однако мы не выявили взаимосвязи между количеством ЖЭК, наличием ЖТ и снижением ФВ. Как известно, снижение ФВ <40% считается фактором высокого риска внезапной сердечной смерти (ВСС), однако лишь 13% ВСС случаются у пациентов с нФВ [49]. В последнее время многие исследователи [50-54] говорят о том, что только ФВ недостаточно для стратификации риска развития ЖНР, и полученные нами данные подтверждают это мнение.
В нашем исследовании была установлена взаимосвязь между наличием относительно нового ЭКГ-показателя — fQRS и систолической дисфункцией миокарда ЛЖ. В настоящее время большинство ученых рассматривают fQRS как маркер высокого риска развития аритмических событий и ВСС, в т.ч. у пациентов с нФВ, а также он является ЭКГпризнаком, ассоциированным с фиброзом миокарда различного генеза. Нам удалось найти небольшое количество исследований, в которых fQRS рассматривали как признак снижения ФВ. В частности, в работе Zhao Q, et al. получены сходные с нашими результаты: у пациентов с инфарктом миокарда наличие fQRS было ассоциировано с повышением уровня мозгового натрийуретического пептида и снижением ФВ [55]. А в недавнем исследовании 2020г на 500 здоровых лицах была продемонстрирована взаимосвязь fQRS с региональной диастолической дисфункцией ЛЖ [35].
Несмотря на то, что в основе возникновения ФРРЖ на ЭКГ также могут лежать и структурные изменения миокарда, нами не была установлена взаимосвязь между наличием этого ЭКГ-паттерна и снижением ФВ. Вероятно, ФРРЖ следует рассматривать в первую очередь как маркер электрической нестабильности миокарда, указывающий на высокий риск развития ЖНР, но не на систолическую дисфункцию ЛЖ.
Важной задачей нашей работы был поиск ЭКГпризнаков, способных указывать на пФВ. Несмотря на то, что наиболее часто в исследуемых группах регистрировался патологический зубец Q, именно fQRS оказалась маркером, в большей степени ассоциированным с пФВ.
Ограничения исследования. Анализ значимости отведений и морфологии ФРРЖ и fQRS был ограничен в связи с небольшим количеством наблюдений. Также не была определена риск-стратификационная значимость исследуемых ЭКГ-признаков, т.к. это не входило в цели исследования.
Заключение
ЭКГ остается ведущим скрининговым методом обследования, позволяющим заподозрить патологию сердечно-сосудистой системы. Однако традиционных ЭКГ-признаков недостаточно для решения задачи по выявлению больных с пФВ. Следует обращать внимание на пациентов с выявленным fQRS, который может быть не только маркером высокого риска развития ЖНР или структурных изменений миокарда, но и признаком, указывающим на умеренное снижение ФВ. В рутинной практике поиск fQRS может повысить роль ЭКГ в выявлении таких пациентов.
Также в настоящее время крайне актуален вопрос риск-стратификации пациентов с нФВ. Результаты, полученные в нашем исследовании, подтверждают необходимость дальнейшего исследования рискстратификационной значимости известных маркеров электрической нестабильности миокарда и разработки новых подходов к риск-стратификации пациентов со снижением ФВ, основанных не только на уровне снижения ФВ и наличии желудочковой аритмии, но и на наличии других прогностически значимых ЭКГ-признаков.
Отношения и деятельность. Исследование выполнено при поддержке гранта Министерства науки и высшего образования Российской Федерации (соглашение № 075-15-2020-800).
Список литературы
1. Braunwald E. Cardiovascular Medicine at the Turn of the Millennium: Triumphs, Concerns, and Opportunities. N Engl J Med. 1997;337:1360-9. doi:10.1056/NEJM199711063371906.
2. Поляков Д. С., Фомин И. В., Беленков Ю. Н. и др. Хроническая сердечная недостаточность в Российской Федерации: что изменилось за 20 лет наблюдения? Результаты исследования ЭПОХА-ХСН. Кардиология 2021;61(4):4-14. doi:10.18087/cardio.2021.4.n1628.
3. Фомин И. В. Хроническая сердечная недостаточность в Российской Федерации: что сегодня мы знаем и что должны делать. Российский кардиологический журнал. 2016;(8):7-13. doi:10.15829/15604071-2016-8-7-13.
4. Taylor CJ, Ordóñez-Mena JM, Roalfe AK, et al. Trends in survival after a diagnosis of heart failure in the United Kingdom 2000-2017: population based cohort study. BMJ. 2019;364:l223. doi:10.1136/bmj.l223.
5. Sandhu AT, Tisdale RL, Rodriguez F, et al. Disparity in the Setting of Incident Heart Failure Diagnosis. Circ Heart Fail. 2021;14(8):e008538. doi:10.1161/CIRCHEARTFAILURE.121.008538.
6. Ponikowski P, Voors AA, Anker SD, et al. 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: the Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC) Developed with the special contribution of the Heart Failure Association (HFA) of the ESC. Eur Heart J. 2016;37(27):2129-200. doi:10.1093/eurheartj/ehw128.
7. Solomon SD, Vaduganathan M, Claggett BL, et al. Baseline Characteristics of Patients With HF With Mildly Reduced and Preserved Ejection Fraction: DELIVER Trial. JACC Heart Fail. 2022;10(3):184-97. doi:10.1016/j.jchf.2021.11.006.
8. Abdul-Rahim AH, Shen L, Rush CJ, et al. Effect of digoxin in patients with heart failure and mid-range (borderline) left ventricular ejection fraction. Eur J Heart Fail. 2018;20(7):113945. doi:10.1002/ejhf.1160.
9. Kotecha D, Flather MD, Altman DG, et al. Heart Rate and Rhythm and the Benefit of Beta-Blockers in Patients With Heart Failure. J Am Coll Cardiol. 2017;69(24):2885-96. doi:10.1016/j.jacc.2017.04.001.
10. Solomon SD, Claggett B, Lewis EF, et al. Influence of ejection fraction on outcomes and efficacy of spironolactone in patients with heart failure with preserved ejection fraction. Eur Heart J. 2016;37(5):455-62. doi:10.1093/eurheartj/ehv464.
11. Nauta JF, Hummel YM, van Melle JP, et al. What have we learned about heart failure with mid-range ejection fraction one year after its introduction? Eur J Heart Fail. 2017;19(12):1569-73. doi:10.1002/ejhf.1058.
12. Daamen M, Brunner-la Rocca H, Tan FE, et al. Clinical diagnosis of heart failure in nursing home residents based on history, physical exam, BNP and ECG: Is it reliable? European Geriatric Medicine. 2017;8(1):59-65. doi:10.1016/j.eurger.2016.10.003.
13. van Ommen AM, Kessler EL, Valstar G, et al. Electrocardiographic Features of Left Ventricular Diastolic Dysfunction and Heart Failure With Preserved Ejection Fraction: A Systematic Review. Front Cardiovasc Med. 2021;8:772803. doi:10.3389/fcvm.2021.772803.
14. Coronel R, Wilders R, Verkerk AO, et al. Electrophysiological changes in heart failure and their implications for arrhythmogenesis. Biochim Biophys Acta. 2013;1832(12):2432-41. doi:10.1016/j.bbadis.2013.04.002.
15. Ding WY, Cooper R, Todd D, et al. Natural progression of QRS duration in ICD-only patients. J Interv Card Electrophysiol. 2018;53(1):47-51. doi:10.1007/s10840-018-0394.
16. Magnani JW, Wang N, Nelson KP, et al. Electrocardiographic PR Interval and Adverse Outcomes in Older Adults. Circulation: Arrhythmia and Electrophysiology. 2013;6(1):8490. doi:10.1161/CIRCEP.112.975342.
17. Alawieh H, El Chemaly T, Alam S, et al. Towards Point-of-Care Heart Failure Diagnostic Platforms: BNP and NT-proBNP Biosensors. Sensors. 19(22):5003. doi:10.3390/s19225003.
18. Olesen LL, Andersen A. ECG as a first step in the detection of left ventricular systolic dysfunction in the elderly. ESC Heart Fail. 2016;3(1):44-52. doi:10.1002/ehf2.12067.
19. Nikolaidou T, Samuel NA, Marincowitz C, et al. Electrocardiographic characteristics in patients with heart failure and normal ejection fraction: A systematic review and meta‐analysis. Ann Noninvasive Electrocardiol. 2020;25(1):e12710. doi:10.1111/anec.12710.
20. Nguyen TP, Qu Z, Weiss JN. Cardiac fibrosis and arrhythmogenesis: The road to repair is paved with perils. J Mol Cell Cardiol. 2014;70:83-91. doi:10.1016/j.yjmcc.2013.10.018.
21. Пармон Е. В., Трешкур Т. В., Гордеева М. С. Современные представления о роли электрокардиографии в определении фиброза миокарда и диагностике первичных аритмогенных синдромов для профилактики внезапной сердечной смерти. Трансляционная медицина. 2020:533-63.
22. Tangwiwat C, Kaolawanich Y, Krittayaphong R. Electrocardiographic predictors of myocardial fibrosis and apical hypertrophic cardiomyopathy. Ann Noninvasive Electrocardiol. 2019;24(2):e12612. doi:10.1111/anec.12612.
23. Kadi H, Kevser A, Ozturk A, et al. Fragmented QRS Complexes Are Associated with Increased Left Ventricular Mass in Patients with Essential Hypertension. Ann Noninvasive Electrocardiol. 2013;18(6):547-54. doi:10.1111/anec.12070.
24. Eyuboglu M. Fragmented QRS as a Marker of Myocardial Fibrosis in Hypertension: a Systematic Review. Curr Hypertens Rep. 2019;21(10):73. doi:10.1007/s11906-0190982-3.
25. Bozbeyoğlu E, Yıldırımtürk Ö, Yazıcı S, et al. Fragmented QRS on Admission Electrocardiography Predicts Long-Term Mortality in Patients with Non-ST-Segment Elevation Myocardial Infarction. Ann Noninvasive Electrocardiol. 2016;21(4):352-7. doi:10.1111/anec.12314.
26. Kanjanahattakij N, Rattanawong P, Riangwiwat T, et al. Fragmented QRS and mortality in patients undergoing percutaneous intervention for ST-elevation myocardial infarction: Systematic review and meta-analysis. Ann Noninvasive Electrocardiol. 2018;23(6):e12567. doi:10.1111/anec.12567.
27. Tanriverdi Z, Colluoglu T, Unal B, et al. The prognostic value of the combined use of QRS distortion and fragmented QRS in patients with acute STEMI undergoing primary percutaneous coronary intervention. J Electrocardiol. 2018;51(2):210-7. doi:10.1016/j.jelectrocard.2017.09.014.
28. Гордеева М. С., Пармон Е. В., Карлина В. А. и др. Фрагментация QRS-комплекса как маркер фиброза миокарда у пациентов с ишемической болезнью сердца. Наука и инновации в медицине. 2022;7(2):95-102. doi:10.35693/2500-1388-2022-7-2-95-102.
29. Пармон Е. В., Гордеева М. С., Куриленко Т. А. и др. Фрагментация QRSкомплекса — важный электрокардиографический маркер нарушения деполяризации. Российский кардиологический журнал. 2017;(8):90-5. doi:10.15829/1560-40712017-8-90-95.
30. Ogura S, Nakamura K, Morita H, et al. New Appearance of Fragmented QRS as a Predictor of Ventricular Arrhythmic Events in Patients With Hypertrophic Cardiomyopathy. Circ J. 2020;84(3):487-94. doi:10.1253/circj.CJ-19-0968.
31. Lu X, Wang W, Zhu L, et al. Prognostic Significance of Fragmented QRS in Patients with Hypertrophic Cardiomyopathy. Cardiology. 2017;138(1):26-33. doi:10.1159/000471845.
32. Rattanawong P, Riangwiwat T, Prasitlumkum N, et al. Baseline fragmented QRS increases the risk of major arrhythmic events in Brugada syndrome: Systematic review and metaanalysis. Ann Noninvasive Electrocardiol. 2018;23(2):e12507. doi:10.1111/anec.12507.
33. Kanitsoraphan C, Rattanawong P, Mekraksakit P, et al. Baseline fragmented QRS is associated with increased all-cause mortality in heart failure with reduced ejection fraction: A systematic review and meta-analysis. Ann Noninvasive Electrocardiol. 2019;24(2):e12597. doi:10.1111/anec.12597.
34. Liu P, Wu J, Wang L, et al. The prevalence of fragmented QRS and its relationship with left ventricular systolic function in chronic kidney disease. J Int Med Res. 2020;48(4):300060519890792. doi:10.1177/0300060519890792.
35. Nikoo MH, Jamali Z, Razeghian-Jahromi I, et al. Fragmented QRS as an early predictor of left ventricular systolic dysfunction in healthy individuals: a nested case-control study in the era of speckle tracking echocardiography. Cardiovasc Ultrasound. 2020;18(33). doi:10.1186/s12947-020-00216-z.
36. Bayramoğlu A, Taşolar H, Bektaş O, et al. Association between fragmented QRS complexes and left ventricular dysfunction in healthy smokers. Echocardiography. 2019;36(2):292-6. doi:10.1111/echo.14223.
37. Miragoli M, Goldoni M, Demola P, et al. Left ventricular geometry correlates with early repolarization pattern in adolescent athletes. Scand J Med Sci Sports. 2019;29(11):172735. doi:10.1111/sms.13518.
38. Azevedo PO, Guerreiro C, Ladeiras-Lopes R, et al. Early Repolarization Pattern and Left Ventricular Mass in Hypertrophic Cardiomyopathy. Cardiology. 2020;145(5):303-8. doi:10.1159/000505639.
39. Гордеева М. С., Земсков И. А., Соколова А. А. и др. ЭКГ — признаки ранней реполяризации желудочков (феномен и синдром ранней реполяризации желудочков). Трансляционная медицина. 2018;5(4):23-34. doi:10.18705/2311-4495-20185-4-23-34.
40. Cheng YJ, Li ZY, Yao FJ, et al. Early repolarization is associated with a significantly increased risk of ventricular arrhythmias and sudden cardiac death in patients with structural heart diseases. Heart Rhythm. 2017;14(8):1157-64. doi:10.1016/j.hrthm.2017.04.022.
41. Cheng Y, Zhao XX, Pan SP, et al. Association of early repolarization pattern with cardiovascular outcomes in middle‐aged population: A cohort study Clin Cardiol. 2020;43(12):1601-8. doi:10.1002/clc.23488.
42. Ikeda-Yorifuji I, Yamada T, Tamaki S, et al. Prediction of sudden cardiac death in chronic heart failure patients with reduced ejection fraction by ADMIRE-HF risk score and early repolarization pattern. J Nucl Cardiol. 2020;27(3):992-1001. doi:10.1007/s12350-01901639-6.
43. Das MK, Zipes DP. Fragmented QRS: a predictor of mortality and sudden cardiac death. Heart Rhythm. 2009;6 (3 Suppl):S8-14. doi:10.1016/j.hrthm.2008.10.019.
44. MacFarlane PW, Antzelevitch C, Haissaguerre M, et al. The early repolarization pattern: A consensus paper. J Am Coll Cardiol. 2015;66(4):470-7. doi:10.1016/j.jacc.2015.05.033.
45. López‐Castillo M, Aceña Á, Pello-Lázaro AM, et al. Prognostic value of initial QRS analysis in anterior STEMI: Correlation with left ventricular systolic dysfunction, serum biomarkers, and cardiac outcomes. Ann Noninvasive Electrocardiol. 2021;26(1):e12791. doi:10.1111/anec.12791.
46. Delewi R, Ijff G, van de Hoef TP, et al. Pathological Q Waves in Myocardial Infarction in Patients Treated by Primary PCI. JACC Cardiovasc Imaging. 2013;6(3):324-31. doi:10.1016/j.jcmg.2012.08.018.
47. Akgun T, Kalkan S, Tigen KM, Variations of QRS morphology in patients with dilated cardiomyopathy; clinical and prognostic implications. J Cardiovasc Thorac Res. 2014;6(2):85-9. doi:10.5681/jcvtr.2014.019.
48. Boyle N. A Clinical Review of Ventricular Arrhythmias in Patients with Congestive Heart Failure. EMJ Cardiol. 2019. doi:10.33590/emjcardiol/18-00058R1.
49. Wellens HJ, Schwartz PJ, Lindemans FW, et al. Risk stratification for sudden cardiac death: current status and challenges for the future. Eur Heart J. 2014;35(25):1642-51. doi:10.1093/eurheartj/ehu176.
50. Rusnak J, Behnes M, Weiß C, et al. Impact of Left Ventricular Ejection Fraction on Recurrent Ventricular Tachyarrhythmias in Recipients of Implantable Cardioverter Defibrillators. Cardiology. 2020;145(6):359-69. doi:10.1159/000504876.
51. Dong Y, Shi Y, Wang J, et al. Development and Validation of a Risk Prediction Model for Ventricular Arrhythmia in Elderly Patients with Coronary Heart Disease. Cardiol Res Pract. 2021;2021:2283018. doi:10.1155/2021/2283018.
52. Ramírez J, Orini M, Mincholé A, et al. Sudden cardiac death and pump failure death prediction in chronic heart failure by combining ECG and clinical markers in an integrated risk model. PLoS One. 2017;12(10):e0186152. doi:10.1371/journal.pone.0186152.
53. al Badarin FJ, Peri-Okonny P. The quest to improve sudden cardiac death prediction using sympathetic innervation scintigraphy: Chasing a mirage? J Nucl Cardiol. 2020;27(3):10024. doi:10.1007/s12350-019-01741-9.
54. Wu KC, Calkins H. Powerlessness of a Number: Why Left Ventricular Ejection Fraction Matters Less for Sudden Cardiac Death Risk Assessment. Circ Cardiovasc Imaging. 2016;9(10):e005519. doi:10.1161/CIRCIMAGING.116.005519.
55. Zhao Q, Zhang R, Hou J, et al. Relationship between Fragmented QRS and NT-proBNP in Patients with ST Elevation Myocardial Infarction Who Underwent Primary Percutaneous Coronary Intervention. Acta Cardiol Sin. 2018;34(1):13-22. doi:10.6515/ACS.201801_34(1).20170903A.
Об авторах
М. С. ГордееваРоссия
Мария Сергеевна Гордеева — врач-кардиолог.
Санкт-Петербург
Конфликт интересов:
нет
И. А. Сердюкова
Россия
Ирина Анатольевна Сердюкова — магистр по направлению “Инфокоммуникационные технологии и системы связи”, аспирант кафедры радиотехнических систем.
Санкт-Петербург
Конфликт интересов:
нет
А. С. Красичков
Россия
Александр Сергеевич Красичков — доктор технических наук, профессор кафедры радиотехнических систем.
Санкт-Петербург
Конфликт интересов:
нет
Е. В. Пармон
Россия
Елена Валерьевна Пармон — директор института медицинского образования, кандидат медицинских наук, доцент кафедры внутренних болезней.
Санкт-Петербург
Конфликт интересов:
нет
Дополнительные файлы
Рецензия
Для цитирования:
Гордеева М.С., Сердюкова И.А., Красичков А.С., Пармон Е.В. Электрокардиографические признаки нарушения процессов деполяризации (фрагментация QRS-комплекса, феномен ранней реполяризации желудочков и др.) как маркеры систолической дисфункции левого желудочка. Российский кардиологический журнал. 2022;27(7):5113. https://doi.org/10.15829/1560-4071-2022-5113
For citation:
Gordeeva M.S., Serdiukova I.A., Krasichkov A.S., Parmon E.V. Electrocardiographic signs of impaired depolarization (fragmented QRS, early ventricular repolarization, etc.) as markers of left ventricular systolic dysfunction. Russian Journal of Cardiology. 2022;27(7):5113. (In Russ.) https://doi.org/10.15829/1560-4071-2022-5113
JATS XML

















































