Перейти к:
Деформационные характеристики миокарда и вагосимпатический баланс при различных вариантах течения постинфарктного периода на фоне высокодозовой терапии аторвастатином
https://doi.org/10.15829/1560-4071-2022-5078
Аннотация
Цель. Изучить у больных инфарктом миокарда с подъемом сегмента ST (ИМпST) динамику параметров деформации левого желудочка (ЛЖ) и вариабельности сердечного ритма (ВСР) при различных вариантах течения постинфарктного периода на фоне высокодозовой терапии аторвастатином.
Материал и методы. В исследование включено 96 больных ИМпST. Всем пациентам проводили двухмерную эхокардиографию c методикой спеклтрекинг и суточное мониторирование электрокардиограммы с анализом ВСР. Включенные лица были поделены на группы без патологического ремоделирования ЛЖ ("БПР", n=57) и с патологическим постинфарктным ремоделированием ЛЖ ("ПР", n=39), критерием которого стало увеличение индексов конечного диастолического >20% и/или систолического >15% объемов. Далее в зависимости от достижения/не достижения целевого уровня холестерина липопротеидов низкой плотности (ХС ЛНП) — 1,5 ммоль/л и/или снижения более чем на 50%, выделили подгруппы: 17 (43,6%) человек, достигшие целевого уровня ХС ЛНП — "ВЭТ-ПР" и 22 (56,4%) больных, не достигшие целевого уровня ХС ЛНП — "ОЭТ-ПР". Аналогичные подгруппы выделили в группе "БПР": 28 (49,1%) человек "ВЭТ-БПР" и 29 (50,9%) лиц "ОЭТ-БПР".
Результаты. В подгруппе "ОЭТ-ПР", начиная с 12 нед. наблюдения, зарегистрировано ухудшение глобальной продольной (GLS), циркулярной (GCS) и радиальной (GRS) деформаций (р<0,01). В подгруппе "ВЭТ-ПР" ухудшение данных видов деформаций зарегистрировали лишь к 48 нед. наблюдения (р<0,01). В подгруппе "ВЭТ-БПР" выявлено увеличение GLS к 48 нед. наблюдения (р=0,001), GCS и GRS — к 12 нед. (р<0,05). В подгруппе "ОЭТ-БПР" благоприятную динамику наблюдали только по GLS и GCS к 48 нед. (р<0,01). Значимое изменение уровня параметров ВСР наблюдалось в подгруппе "ВЭТ-БПР". К 48 нед. отмечен прирост временных показателей (SDNN, SDNNi, SDANN, RMSSD, рNN50) (р<0,0001) и общей мощности спектра (р=0,0001) за счет роста всех частотных показателей (р<0,001), индекс вагосимпатического баланса L/H снизился на 33% (р=0,002). В подгруппе "ОЭТ-БПР" выявлен рост лишь SDNN, SDANN и рNN50 (р<0,05), а также общей мощности спектра (р=0,001), но без изменения отдельных частот. При межгрупповом анализе в остром периоде ИМпST у больных подгруппы "ОЭТ-БПР" ВСР была выше, чем у пациентов подгруппы "ВЭТ-БПР" (р<0,05).
Заключение. Высокоэффективная гиполипидемическая терапия аторвастатином благоприятно воздействует на деформационные характеристики ЛЖ и восстановление вагосимпатического баланса в период реабилитации после ИМпST.
Ключевые слова
Для цитирования:
Олейников В.Э., Голубева А.В., Барменкова Ю.А., Кулюцин А.В., Бурко Н.В., Лукьянова М.В., Донецкая Н.А. Деформационные характеристики миокарда и вагосимпатический баланс при различных вариантах течения постинфарктного периода на фоне высокодозовой терапии аторвастатином. Российский кардиологический журнал. 2022;27(12):5078. https://doi.org/10.15829/1560-4071-2022-5078
For citation:
Oleinikov V.E., Golubeva A.V., Barmenkova Yu.A., Kulyutsin A.V., Burko N.V., Lukyanova M.V., Donetskaya N.A. Myocardial strain parameters and autonomic balance in various variants of the postinfarction course in patients receiving high-dose atorvastatin therapy. Russian Journal of Cardiology. 2022;27(12):5078. (In Russ.) https://doi.org/10.15829/1560-4071-2022-5078
В настоящее время назначение статинов — ингибиторов ГМГ-КоА редуктазы, является основой этиопатогенетического лечения инфаркта миокарда (ИМ) с подъемом сегмента ST (ИМпST). Помимо липидснижающего действия, статины обладают плейотропным эффектом: антиишемическим, противовоспалительным, антиоксидантным, антипролиферативным и другими [1][2]. В отдельных работах эффективное лечение статинами связывают с торможением постинфарктной дилатации полости левого желудочка (ЛЖ) [3], а также замедлением прогрессирования хронической сердечной недостаточности (ХСН) [4]. Оказывая влияние на сложные механизмы развития постинфарктного ремоделирования, статины, вероятно, могут непосредственно приводить к улучшению сократительной способности сердечной мышцы, что, в свою очередь, благоприятно влияет на процессы электрической стабильности миокарда, в частности, поддержания вагосимпатического баланса [5]. Так, результаты исследования MADIT-II показали, что прием статинов был ассоциирован со снижением риска сердечной смерти, частотой жизнеугрожающих аритмических событий у постинфарктных больных, на основании чего авторы предположили наличие антиаритмических свойств у данной группы препаратов [6]. Для изучения данного вопроса в современной кардиологии имеется ряд диагностических методик, а именно, эхокардиография (ЭхоКГ) с применением спекл-трекинга (STE), позволяющего оценивать деформацию ЛЖ в трех направлениях, и суточное мониторирование электрокардиограммы (ЭКГ) с оценкой вариабельности сердечного ритма (ВСР).
Таким образом, целью настоящего исследования являлось изучение у больных ИМпST динамики параметров деформации ЛЖ и вагосимпатического баланса при различных вариантах течения постинфарктного периода на фоне высокодозовой терапии аторвастатином.
Материал и методы
Проспективное открытoе сравнительное одноцентровое контролируемое клиническое исследование с ретроспективным анализом проводилось нa базe ГБУЗ "Пензенская областная клиническая больница им. Н.Н. Бурденко". Данная работа была проведена в рамках клинического исследования "КОНТРАST" с идентификационным номером NCT02590653 (clinicaltrials.gov). Локальный этический комитет ПГУ одобрил образцы исходной документации и протокол исследования. Все обследуемые подписывали информированное согласие до включения в исследование.
Скрининг пациентов проходил с сентября 2014г по декабрь 2019г в отделении неотложной кардиологии клинической больницы им. Н. Н. Бурденко. Из 1456 скринированных больных в настоящее исследование было включено 113 пациентов с подтвержденным ИМпST. Активное лечение с отсечкой в 48 нед. прошли 96 пациентов.
Критерии включения: умственная и физическая способность к участию в исследовании; 2-4 сут. ИМпST; возраст от 35 до 65 лет; подтвержденный гемодинамически значимый стеноз (>75%) одной коронарной артерии (инфаркт-связанная артерия). Критериями исключения были стеноз ствола левой коронарной артерии >30% или двух и более других венечных артерий >50%; повторный инфаркт и/или его рецидивирующее течение; ХСН выше 1 функционального класса в анамнезе; неконтролируемая артериальная гипертензия; тяжелые нарушения сердечного ритма и проводимости; сахарный диабет 1 типа или 2 типа, инсулинпотребный; хроническая болезнь почек выше 3А стадии (клиренс креатинина <30 мл/мин); активные заболевания печени; другие тяжелые сопутствующие заболевания; индивидуальная непереносимость препаратов ГМГ-КоАредуктазы.
Всем больным проводилась реваскуляризация. Первичному чрескожному коронарному вмешательству подверглись 39 (40,6%) пациентов. Фармакоинвазивная стратегия реализована у 57 (59,4%) обследуемых.
Пациентам назначали в полном объеме терапию согласно Российским и Европейским рекомендациям по ведению больных с ИМпST [7]. В частности, с 24-96 ч ИМпST они получали аторвастатин в дозе 40-80 мг/сут. В соответствии с дизайном период лечения и наблюдения составил 48 нед., на протяжении которых проводилось комплексное лабораторно-инструментальное обследование на 12-, 24- и 48-й нед.
Все обследуемые лица были поделены на группы: с патологическим постинфарктным ремоделированием ("ПР", n=39) и группа без патологического ремоделирования ("БПР", n=57). Патологическое ремоделирование было определено как увеличение индекса конечного диастолического объема >20% и/ или индекса систолического объема >15% на любом визите по сравнению с исходным уровнем, измеренным на 7-9 сут. [8].
В каждой группе в зависимости от достижения/ не достижения целевого уровня (ЦУ) холестерина липопротеидов низкой плотности (ХС ЛНП) — 1,5 ммоль/л и/или снижения более чем на 50%, выделяли подгруппы: 17 (43,6%) человек, достигшие ЦУ — высокоэффективная терапия аторвастатином "ВЭТ-ПР" и 22 (56,4%) человека, не достигшие ЦУ — относительно эффективная терапия (ОЭТ) "ОЭТПР". В группе "БПР": 28 (49,1%) человек "ВЭТ-БПР" и 29 (50,9%) лиц "ОЭТ-БПР".
Общее самочувствие пациентов отслеживали по данным визуально-аналоговой шкалы. Анализировали прогрессирование клинических симптомов ХСН по результатам Миннесотского опросника.
На каждом визите регистрировали нежелательные явления и достижение конечных точек: прогрессирование ХСН, смерть, ИМ, нестабильная стенокардия, нарушение ритма, проведение кардиохирургических вмешательств.
Биохимические исследования выполнялись на анализаторе Olympus AU400 (Olympus Corporation, Япония). Определяли липидный спектр (общий холестерин (ОХС), ХС ЛНП, холестерин липопротеидов высокой плотности, триглицериды) и уровень мозгового натрийуретического пептида (BNP).
Трансторакальное ультразвуковое исследование сердца выполняли на 7-9 сут., а также на всех визитах на ультразвуковой системе MyLab90 (Esaote, Италия) с определением фракции выброса (ФВ) по Симпсону биплан, конечных диастолического и систолического объемов ЛЖ и их индексированных показателей.
Для количественной оценки сократительной способности миокарда ЛЖ использовали ультразвуковую методику STE ЭхоКГ (MyLab 90, Esaote, Италия) с помощью программного обеспечения X-Strain™. Регистрировали глобальную продольную деформацию (GLS) (%), глобальную циркулярную деформацию (GCS) (%), глобальную радиальную деформацию (GRS) (%) ЛЖ и параметры ротационной механики (базальная ротация (Rot bas), апикальная ротация (Rot apex), скручивание ЛЖ (Twist), выраженные в градусах).
С целью оценки изменения тонуса вегетативной нервной системы всем пациентам на 7-9 сут., 24- и 48-й нед. постинфарктного периода проводили суточное мониторирование ЭКГ с анализом временных и спектральных параметров ВСР, используя систему холтеровского мониторирования "Astroсard" (ЗАО "Медитек", Россия) с применением 12-канальных регистраторов.
На каждом визите регистрировали нежелательные явления и достижение конечных точек: прогрессирование ХСН, смерть, ИМ, нестабильная стенокардия, жизнеугрожающие нарушения ритма, проведение кардиохирургических вмешательств.
Статистическая обработка данных проводилась в программе Statistica 13.0 компании StatSoft Inc. (США). Значения указывали с учетом 95% доверительного интервала (ДИ). При анализе полученных данных использовали метод однофакторного дисперсионного анализа — Analysis of Variance — ANOVA. При сопоставлении качественных признаков для парных выборок применяли критерий МакНемара, для независимых — χ2. Для определения допустимости развития конечных точек рассчитывали отношение рисков (ОР) и отношение шансов (ОШ). Данные указывались с учетом 95% ДИ, а статистически значимый риск развития неблагоприятного события считался тогда, когда нижняя и верхняя граница ДИ была >1. При использовании вышеуказанных статистических методов анализа результатов исследования в качестве порога статистической значимости принималось значение р<0,05.
Работа выполнена при финансовой поддержке российского фонда фундаментальных исследований в рамках научных проектов № 19-315-90024/19, № 19-315-90031/19.
Результаты
К моменту окончания активного лечения (48 нед.), участие в исследовании закончили 96 пациентов (84,9%). Один пациент умер на 16 сут. от разрыва аневризмы ЛЖ, 4 больных в связи со сменой места жительства не смогли посещать клинику, 7 человек были исключены из-за низкого качества эхокардиографического изображения, с 5 больными был утрачен контакт.
Анализ клинико-демографической характеристики в подгруппах не выявил достоверных различий (табл. 1).
Во всех подгруппах с 12 нед. статинотерапии уровень ХС ЛНП достоверно снижался относительно исходных значений (р<0,05): в подгруппе "ОЭТ-БПР" — на 40%, в "ВЭТ-БПР" — на 47%, в "ОЭТ-ПР" — на 33%, в "ВЭТ-ПР" — на 59%. Однако в подгруппах "ВЭТ-ПР" и "ВЭТ-БПР" вне зависимости от развития патологического ремоделирования ЛЖ, значения ОХС и ХС ЛНП были ниже (р<0,01) на протяжении всего периода наблюдения.
При изучении динамики уровня BNP только в подгруппе "ОЭТ-ПР" не выявили статистически значимого снижения значений (рис. 1). Следует отметить, что у обследуемых подгруппы "ВЭТ-БПР" регистрировали более выраженное снижение — 54,8% к 24 нед. (p=0,009), а к окончанию наблюдения на 66,2% (p=0,007), в то время как у обследуемых подгруппы "ОЭТ-БПР" снижение произошло на 25,5% к 24 нед. (p=0,03) и на 41,9% к 48 нед. (p=0,0011).
Анализ данных визуально-аналоговой шкалы выявил улучшение самочувствия в подгруппах "ВЭТ-ПР" и "ВЭТ-БПР" (р<0,01) в отличие от подгрупп с отсутствием достижения ЦУ ХС ЛНП (рис. 2). Ре - зультаты анализа Миннесотского опросника показали ухудшение качества жизни в подгруппе "ОЭТ-ПР" уже к 12 нед. (р<0,05), а в подгруппе "ОЭТ-БПР" — к 24 нед. наблюдения (р<0,05), при этом межгрупповое сравнение выявило отличие на 48 нед. (р<0,01) с более высокими баллами в подгруппе "ОЭТ-ПР" (рис. 2).
В подгруппе "ОЭТ-ПР" уже к 24 нед. наблюдалось снижение ФВ ЛЖ (р=0,04) в отличие от "ВЭТ-ПР", где достоверного ухудшения выявлено не было. У обследуемых в подгруппах без признаков патологического ремоделирования, напротив, выявлен рост ФВ ЛЖ к 48 нед., особенно, на фоне достижения ЦУ ХС ЛНП (р<0,01) (табл. 2).
Особого внимания заслуживает изучение деформационных свойств ЛЖ (рис. 3). Ухудшение глобальной продольной деформации к 48 нед. наблюдения (р<0,01) было зарегистрировано лишь в подгруппе "ОЭТ-ПР", тогда как в группе с патологическим ремоделированием и достигнутым ЦУ ХС ЛНП отрицательной динамики GLS не наблюдалось. При изучении GCS и GRS выраженная отрицательная динамика с 12 нед. (р<0,01) наблюдалась у лиц подгруппы "ОЭТ-ПР", в подгруппе "ВЭТ-ПР" ухудшение данных видов деформаций зарегистрировали лишь к концу наблюдения (р<0,01).
В подгруппах пациентов без развития патологического ремоделирования отмечалась благоприятная динамика деформационных характеристик, однако более выраженная наблюдалась у обследуемых с высокоэффективной терапией аторвастатином. В этой подгруппе регистрировали увеличение GLS к 48 нед. наблюдения (р=0,001), GCS и GRS — к 12 нед. (р<0,05) с сохранением положительной динамики к окончанию наблюдения. В подгруппе "ОЭТ-БПР" благоприятную динамику наблюдали только по GLS и GCS к 48 нед. (р<0,01).
Интересные результаты были получены при анализе ротационной механики в подгруппах. Ухудшение апикальной ротации и скручивания к 48 нед. наблюдения зарегистрировано только у пациентов с патологическим ремоделированием и не достигших ЦУ ХС ЛНП (р<0,05).
По данным суточного мониторирования ЭКГ ярко выраженная благоприятная динамика по отдельным параметрам временного и спектрального анализа ВСР наблюдалась в подгруппе "ВЭТ-БПР". Рост большинства временных показателей регистрировался уже к 24 и продолжался до 48 нед. наблюдения. Прирост временных показателей, а именно стандартной погрешности средней продолжительности синусовых интервалов RR (SDNN) составил 27% (р=0,0001), среднего показателя среднеквадратичной погрешности длительности интервалов RR за 5 мин (SDNNi) — 19% (р=0,001), среднего показателя стандартной погрешности для всех синусовых интервалов RR за каждые 5 мин в течение суток (SDANN) — 29% (р=0,0001), квадратного корня суммы разностей зарегистрированных последовательно интервалов RR (RMSSD) — 44% (р=0,0001), доля зарегистрированных последовательно интервалов RR с разницей >50 мс (рNN50) — 92% (р=0,0001). У пациентов подгруппы "ОЭТ-БПР" наблюдалась схожая динамика лишь по некоторым временным показателям: SDNN возрос на 19% (р=0,0001), SDANN — на 26% (р=0,0001), рNN50 — на 37% (р=0,03).
Усиление общей мощности спектра (TotP) (р=0,0001) в подгруппе "ВЭТ-БПР" происходило за счет роста всех частотных показателей: ультранизкочастотной (ULfP), очень низкочастотной (VLfP), низкочастотной (LfP) и высокочастотной (HfP) компонент (р<0,001), при этом индекс вагосимпатического баланса (L/H) снизился на 33% (р=0,002). В подгруппе "ОЭТ-БПР" также достоверно увеличивался показатель TotP на 38% (р=0,001), но без изменения отдельных частот, что характеризует замедленное восстановление ВСР.
У больных с патологическим ремоделированием вне зависимости от достижения ЦУ ХС ЛНП достоверному изменению подверглись лишь несколько показателей: SDNN и SDANN, TotP и ULfP (р<0,01).
Однако в случае высокоэффективной статинотерапии у больных подгруппы "ВЭТ-ПР" наблюдался регресс L/H на 40% (р=0,002), что позволяет сделать вывод о благоприятном влиянии аторвастатина на восстановление ВСР у больных с патологическим постинфарктным ремоделированием ЛЖ в случае достижения ЦУ ХС ЛНП (рис. 4).
При межгрупповом анализе в остром периоде ИМпST у больных подгруппы "ОЭТ-БПР" вариабельность ритма была выше, чем у пациентов подгруппы "ВЭТ-БПР", что нашло отражение в следующих показателях: SDNN составил 115 (95% ДИ 101- 128) vs 112 (95% ДИ 96-124) мс (р=0,04), SDNNi — 54 (95% ДИ 42-63) vs 45 (95% ДИ 38-54) мс (р=0,03), TotP — 14519 (95% ДИ 11762-17240) vs 13652 (95% ДИ 10472-15749) мс2 (р=0,03), LfP — 1531 (95% ДИ 452- 2267) vs 619 (95% ДИ 452-791) мс2 (р=0,03). Тем не менее под влиянием эффективной статинотерапии показатели ВСР в обеих подгруппах к окончанию лечения стали сопоставимы.
Частота регистрации конечных точек была выше в подгруппе "ОЭТ-ПР" — у 10 (45,4%) пациентов, в подгруппе "ВЭТ-ПР" — у 2 (14,3%) человек (р=0,04), ОШ 7,6 (95% ДИ 1,6-33,7). В подгруппах без патологического ремоделирования различий по достижению неблагоприятных клинических исходов не выявлено.
Таблица 1
Сравнительная клинико-демографическая характеристика в подгруппах (n=96)
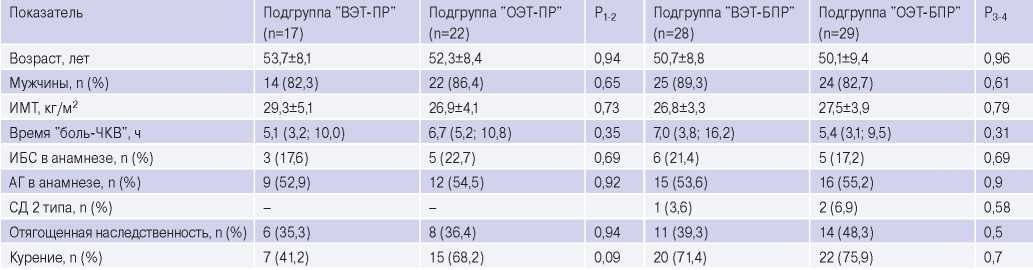
Сокращения: АГ — артериальная гипертензия, ИБС — ишемическая болезнь сердца, ИМТ — индекс массы тела, СД — сахарный диабет, ЧКВ — чрескожное коронарное вмешательство, n — количество пациентов, Р — различия между значениями показателей в подгруппах.
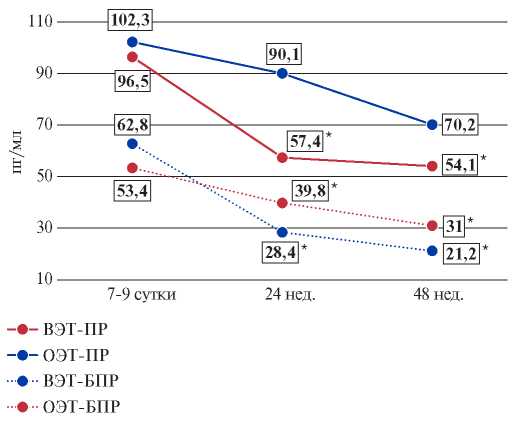
Рис. 1. Динамика уровня BNP в разных подгруппах.
Примечание: * — р<0,05 — различия между значениями показателей на 7-9 сут. и последующими визитами.
Сокращения: ВЭТ-БПР — группа больных без патологического ремоделирования левого желудочка и достижением целевого уровня липопротеидов низкой плотности, ВЭТ-ПР — группа больных с патологическим ремоделированием левого желудочка и достижением целевого уровня липопротеидов низкой плотности, ОЭТ-БПР — группа больных без патологического ремоделирования левого желудочка и отсутствием достижения целевого уровня липопротеидов низкой плотности, ОЭТ-ПР — группа больных с патологическим ремоделированием левого желудочка и отсутствием достижения целевого уровня липопротеидов низкой плотности.
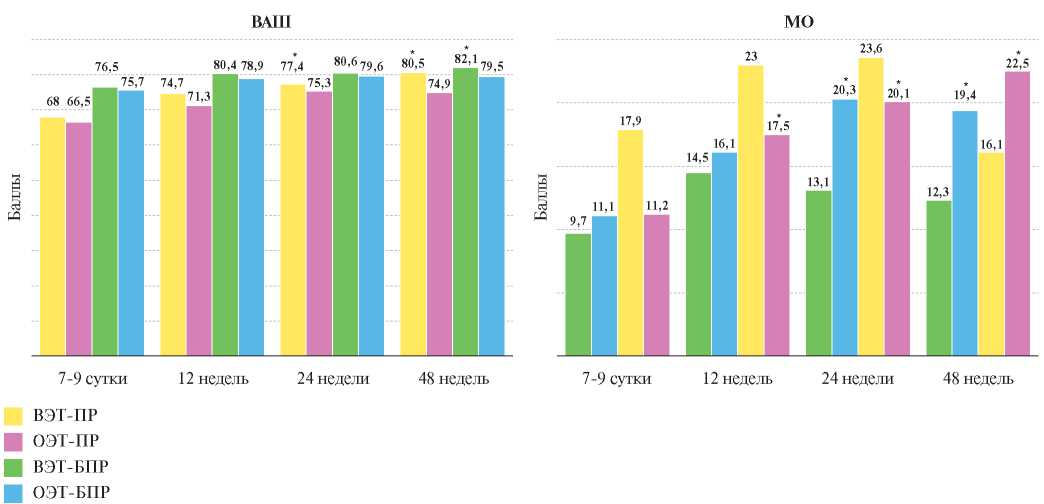
Рис. 2. Динамика результатов оценки собственного здоровья в разных подгруппах.
Примечание: * — р<0,05 — различия между значениями показателей на 7-9 сут. и последующими визитами; ВАШ, МО — шкалы оценки здоровья.
Сокращения: ВЭТ-БПР — группа больных без патологического ремоделирования левого желудочка и достижением целевого уровня липопротеидов низкой плотности, ВЭТ-ПР — группа больных с патологическим ремоделированием левого желудочка и достижением целевого уровня липопротеидов низкой плотности, ОЭТ-БПР — группа больных без патологического ремоделирования левого желудочка и отсутствием достижения целевого уровня липопротеидов низкой плотности, ОЭТ-ПР — группа больных с патологическим ремоделированием левого желудочка и отсутствием достижения целевого уровня липопротеидов низкой плотности.
Таблица 2
Динамика показателя ФВ ЛЖ в подгруппах "ВЭТ-ПР", "ОЭТ-ПР", "ВЭТ-БПР", "ОЭТ-БПР"
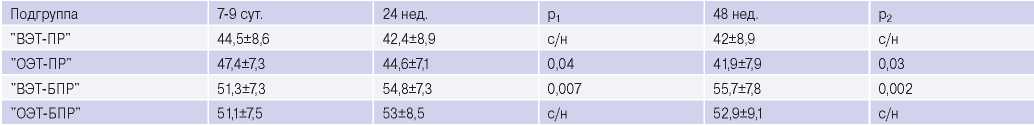
Примечание: р1 — различия между значениями показателей на 7-9 сут. и 24 нед.; р2 — различия между значениями показателей на 7-9 сут. и 48 нед.; с/н — статистически незначимо.
Сокращения: ВЭТ-БПР — группа больных без патологического ремоделирования левого желудочка и достижением целевого уровня липопротеидов низкой плотности, ВЭТ-ПР — группа больных с патологическим ремоделированием левого желудочка и достижением целевого уровня липопротеидов низкой плотности, ОЭТ-БПР — группа больных без патологического ремоделирования левого желудочка и отсутствием достижения целевого уровня липопротеидов низкой плотности, ОЭТ-ПР — группа больных с патологическим ремоделированием левого желудочка и отсутствием достижения целевого уровня липопротеидов низкой плотности.
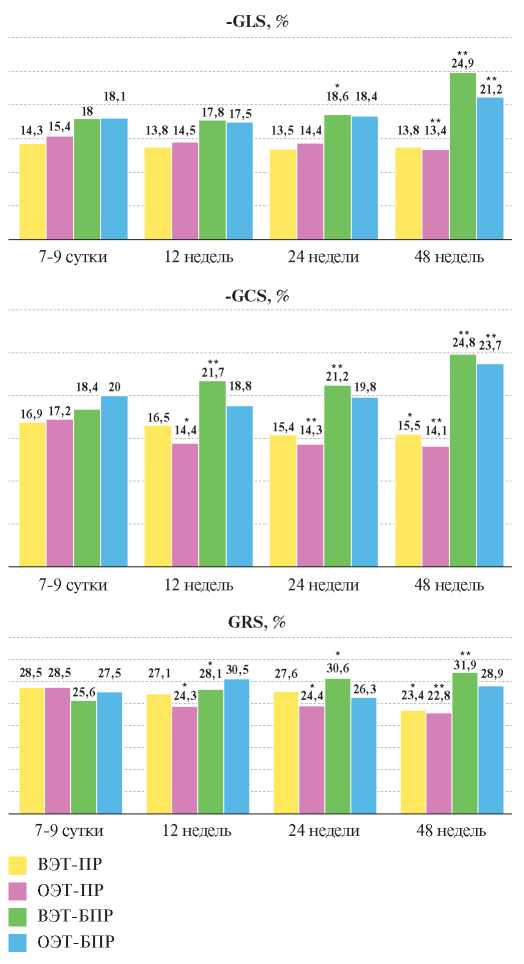
Рис. 3. Деформационные показатели в разных подгруппах в зависимости от эф - фективности статинотерапии.
Примечание: * — р<0,05, ** — р<0,01 — различия между значениями показателей на 7-9 сут. и последующими визитами.
Сокращения: ВЭТ-БПР — группа больных без патологического ремоделирования левого желудочка и достижением целевого уровня липопротеидов низкой плотности, ВЭТ-ПР — группа больных с патологическим ремоделированием левого желудочка и достижением целевого уровня липопротеидов низкой плотности, ОЭТ-БПР — группа больных без патологического ремоделирования левого желудочка и отсутствием достижения целевого уровня липопротеидов низкой плотности, ОЭТ-ПР — группа больных с патологическим ремоделированием левого желудочка и отсутствием достижения целевого уровня липопротеидов низкой плотности, GCS — циркулярная деформация, GLS — глобальная продольная деформация, GRS — радиальная деформация.

Рис. 4. Динамика показателей частотного спектра ВСР в группах "ВЭТ-БПР" и "ВЭТ-ПР".
Примечание: * — р<0,01, ** — р<0,001 — различия между значениями показателей на 7-9 сут. и последующими визитами.
Сокращения: ВЭТ-БПР — группа больных без патологического ремоделирования левого желудочка и достижением целевого уровня липопротеидов низкой плотности, ВЭТ-ПР — группа больных с патологическим ремоделированием левого желудочка и достижением целевого уровня липопротеидов низкой плотности, ОЭТ-БПР — группа больных без патологического ремоделирования левого желудочка и отсутствием достижения целевого уровня липопротеидов низкой плотности, ОЭТ-ПР — группа больных с патологическим ремоделированием левого желудочка и отсутствием достижения целевого уровня липопротеидов низкой плотности.
Обсуждение
В настоящем исследовании на однородной популяции больных, перенесших ИМпST, мы наблюдали формирование ремоделирования ЛЖ с последующим развитием ХСН и оценивали динамику параметров деформации ЛЖ и вагосимпатического баланса на фоне статинотерапии на протяжении 48 нед. Детальный анализ особенностей эволюции деформационных характеристик миокарда и показателей аритмогенеза у постинфарктных пациентов позволил углубить представления о биомеханике ЛЖ в процессе формирования ХСН.
При исследовании динамики уровня BNP было отмечено, что у пациентов подгруппы "ВЭТ-БПР" регистрировалось более выраженное его снижение (на 53,4% к 24 и на 66,4% к 48 нед. наблюдения), чем в подгруппе "ОЭТ-БПР". Примечательно, что в подгруппе "ОЭТ-ПР" отсутствовало снижение BNP. Таким образом, можно предположить благоприятное влияние эффективной статинотерапии на выраженность ХСН по лабораторному маркеру.
Результаты настоящего исследования показали, что эффективная гиполипидемическая терапия аторвастатином приводила к улучшению оценки собственного здоровья, в то время как отсутствие достижения ЦУ ХС ЛНП ассоциировалось с ухудшением качества жизни.
В группе пациентов с патологическим ремоделированием, не достигших ЦУ ХС ЛНП, частота регистрации ХСН с низкой ФВ преобладала над таковой в группе с высокоэффективной терапией, а также возрастал риск развития таких конечных точек, как смерть от сердечных причин, повторные ИМ, госпитализации по поводу ХСН и кардиохирургические вмешательства (пластика аневризмы ЛЖ, аортокоронарное шунтирование, протезирование митрального клапана в связи с развитием митральной недостаточности). Представленные данные согласуются с проведенными ранее исследованиями, в которых было установлено уменьшение частоты смертности от кардиальных причин, повторных ИМ, нестабильной стенокардии, госпитализаций по поводу ХСН [9][10] на фоне статинотерапии у пациентов с ХСН. Интересные данные продемонстрировал метаанализ 23 крупных рандомизированных клинических исследований [9]. Выявлено, что первая нефатальная госпитализация с ХСН была снижена на 10% у больных, принимавших статины (ОР 0,90; 95% ДИ 0,84- 0,97). Риск пациента, страдающего первым комбинированным исходом ХСН (смерть или госпитализация без летального исхода), был снижен на 8% при терапии статинами (ОР 0,92; 95% ДИ 0,85-0,99).
Благодаря ЭхоКГ с проведением дополнительной методики STE, мы смогли оценить влияние эффективной терапии аторвастатином на кардиомеханику. Анализируя подгруппы с развитием патологического ремоделирования, установили, что на фоне успешной гиполипидемической терапии регистрировались менее выраженные изменения систолической функции, поскольку у этих лиц не наблюдали значимого снижения ФВ ЛЖ. Напротив, у лиц без достижения ЦУ ХС ЛНП выявили отрицательную динамику ФВ ЛЖ. Подобную картину влияния на систолическую функцию наблюдали в ряде других исследований, где было отмечено снижение гемодинамических индексов, улучшение ФВ ЛЖ при лечении высокими дозами аторвастатина [3, 9].
Ингибиторы ГМГ-КоА-редуктазы, оказывая плейотропный эффект, вероятно, могут непосредственно приводить к улучшению контрактильности миокарда в постинфарктном периоде. Несмотря на отдельные работы, изучающие влияние статинотерапии на торможение постинфарктной дилатации и улучшение прогноза ХСН, в настоящее время не проведено ни одного клинического исследования, ориентированного на углубленное изучение биомеханики ЛЖ с помощью методики STE. Именно поэтому наблюдение за динамикой параметров STE на фоне приема аторвастатина представляет несомненный интерес.
В рамках настоящего исследования доказано благоприятное воздействие аторвастатина на продольную, циркулярную, радиальную деформацию, а также на ротационную механику, что обусловливало улучшение систолической функции и приводило к повышению клинического благополучия пациентов и снижению риска развития неблагоприятных кардиальных событий в период реабилитации после ИМпST. Таким образом, достижение оптимального уровня ХС ЛНП имеет важнейшее значение в формировании биомеханической стабильности миокарда, что подтверждает необходимость его контроля в постинфарктном периоде.
Многочисленные исследования подтвердили ценность ВСР в прогнозировании общей смертности и прогрессировании ХСН [11][12]. В работе Sassi R, et al. низкая ВСР коррелировала с высоким риском смертности, в т.ч. сердечно-сосудистой [13]. Исследование GISSI-HF продемонстрировало, что у больных с ХСН показатели SDNN, VLfP LfP являются предикторами риска развития сердечно-сосудистой смертности, в то время как VLfP и LfP обладают прогностической ценностью в развитии внезапной коронарной смерти [14]. Имеются данные, что у больных в постинфарктном периоде низкая ВСР является маркером прогрессирования ХСН и способствует выявлению пациентов, нуждающихся в трансплантации сердца [15].
Известно, что на восстановление вегетативного баланса у больных ИМпST влияет комбинация гиполипидемических и иных эффектов статинов, в частности за счет антиоксидантного, противовоспалительного и антиишемического [1][16]. Таким образом, формируется благоприятное влияние на состояние вегетативной регуляции и течение электрофизиологических процессов в миокарде, способствуя становлению антиаритмической устойчивости после ИМпST.
В настоящем исследовании анализ частотных показателей ВСР показал, что лишь при высокоэффективной гиполипидемической терапии в сочетании с отсутствием постинфарктного ремоделирования ЛЖ наблюдался рост высокочастотного компонента HfP, отражающего парасимпатические влияния, что повлияло на снижение коэффициента вагосимпатического баланса L/Н (р<0,01). Кроме того, у больных подгруппы "ВЭТ-ПР" зарегистрирован регресс индекса L/H, однако наряду с этим выявлен рост компонента ULfP, отвечающего за симпатические импульсации (р<0,05). У лиц с патологическим ремоделированием к 48 нед. был зафиксирован более высокий показатель LfP, характеризующий симпатическую активность, и сниженный параметр HfP, отвечающий за парасимпатические импульсации (р<0,05), что говорит о смещении баланса вегетативной нервной системы в сторону симпатики.
Ограничения исследования. Для проведения спеклтрекинг ЭхоКГ измерений необходима точная установка эндокардиальной границы, что требует качественной эхокардиографической визуализации. Кроме того, не представляется возможным проводить измерения деформации и ВСР у пациентов с несинусовым ритмом.
Перспективы. Заслуживает внимания дальнейшее изучение миокардиальной деформации и ротации как индикаторов фармакологической коррекции механизмов развития патологического постинфарктного ремоделирования и нарушений автономной регуляции сердечного ритма.
Заключение
Результаты проведенного исследования дают основания предполагать, что выраженное гиполипидемическое действие статинов (достижение ЦУ ХС ЛНП) в сочетании с плейотропным эффектом способствуют стабилизации и восстановлению контрактильной функции миокарда ЛЖ, возможно, снижая риск развития постинфарктного ремоделирования. Показано благоприятное воздействие аторвастатина на деформационные характеристики ЛЖ, восстановление вагосимпатического баланса и снижение частоты неблагоприятных кардиальных событий в постинфарктном периоде. Таким образом, достижение оптимального уровня ХС ЛНП имеет исключительно важное значение в формировании биомеханической и электрической стабильности миокарда, что подтверждает необходимость его достижения и контроля у больных, перенесших ИМ.
Отношения и деятельность. Работа выполнена при финансовой поддержке российского фонда фундаментальных исследований в рамках научных проектов № 19-315-90031/19, № 19-315-90024/19.
Список литературы
1. Аронов Д. М. Плейотропные эффекты статинов на современном этапе их изучения: фокус на аторвастатин. Часть III. Механизмы плейотропии статинов. CardioСоматика. 2013;4(2):20-6. doi:10.26442/CS44996.
2. Фесенко Э. В., Прощаев К. И., Поляков В. И. Плейотропные эффекты статинотерапии и их роль в преодолении проблемы полиморбидности. Современные проблемы науки и образования. 2012;2:48.
3. Кенжаев М. Л., Аляви А. Л., Кенжаев С. Р. и др. Влияние высоких доз аторвастатина на миокардиальный станнинг и показатели ремоделирования левого желудочка при остром инфаркте миокарда. Вестник экстренной медицины. 2017;1:36-40.
4. Драпкина О. М., Корнеева О. Н., Палаткина Л. О. и др. Статины при лечении хронической сердечной недостаточности. Атеросклероз и дислипидемии. 2016;1(6);32-6.
5. Rubal BJ, Bulgrin JR, Gilman JK. Time-frequency analysis of ECG for late potentials in sudden cardiac death survivors and post-myocardial infarction patients. Biomedical Sciences Instrumentation. 2014;31:109-14.
6. Афанасьев С. А., Невдах А. Е., Роговская Ю. В. и др. Характеристики сердечной мышцы в условиях развившегося постинфарктного кардиосклероза в эксперименте. Экспериментальная и клиническая фармакология. 2013;76(9):19-21. doi:10.30906/0869-2092-2013-76-9-19-21.
7. Российские клинические рекомендации. Острый инфаркт миокарда с подъемом сегмента ST электрокардиограммы: реабилитация и вторичная профилактика. Российский кардиологический журнал. 2015;(1):6-52. doi:10.15829/1560-4071-2015-1-6-52.
8. van der Bijl P, Abou R, Goedemans L, et al. Left Ventricular Post-Infarct Remodeling: Implications for Systolic Function Improvement and Outcomes in the Modern Era. JACC Heart Fail. 2020;8(2):131-40. doi:10.1016/j.jchf.2019.08.014.
9. Preiss D, Campbell RT, Murray HM, еt al. The effect of statin therapy on heart failure events: a collaborative meta-analysis of unpublished data from major randomized trials. Eur Heart J. 2015;21.36(24):1536-46. doi:10.1093/eurheartj/ehv072.
10. Rogers JK, Jhund PS, Perez AC, et al. Effect of rosuvastatin on repeat heart failure hospitalizations: the CORONA trial (controlled rosuvastatin multinational trial in heart failure). JACC Heart Fail. 2014;2:289-97. doi:10.1016/j.jchf.2013.12.007.
11. Hayano J, Yasuma F, Watanabe E, et al. Blunted cyclic variation of heart rate predicts mortality risk in post-myocardial infarction, end-stage renal disease, and chronic heart failure patients. Europace. 2017;19:1392-400. doi:10.1093/europace/euw222.
12. Watanabe E, Kiyono K, Yamamoto Y, et al. Heart rate variability and cardiac diseases. Clinical Assessment of the Autonomic Nervous System — Berlin: Springer, 2016;163-78.
13. Sassi R, Cerutti S, Lombardi F, et al. Advances in heart rate variability signal analysis: Joint position statement by the e‐Cardiology ESC Working Group and the European Heart Rhythm Association co‐endorsed by the Asia Pacific Heart Rhythm Society. Europace. 2015;17:1341-53. doi:10.1093/europace/euv015.
14. La Rovere MT, Pinna GD, Maestri R, et al. Autonomic markers and cardiovascular and arrhythmic events in heart failure patients: Still a place in prognostication? Data from the GISSI‐HF trial GISSI‐HF Investigators. European Journal of Heart Failure. 2012; 1410-9. doi:10.1093/eurjhf/hfs126.
15. Steinberg JS, Varma N, Cygankiewicz I. 2017 ISHE-HRS expert consensus statement on ambulatory ECG and external cardiac monitoring/telemetry. Heart Rhythm. 2017;14(7):55-96. doi:10.1016/j.hrthm.2017.03.038.
16. Ibanez B, James S, Agewall S, et al. 2017 ESC Guidelines for the management of acute myocardial infarction in patients presenting with ST-segment elevation: The Task Force for the management of acute myocardial infarction in patients presenting with ST-segment elevation of the European Society of Cardiology (ESC). European Heart Journal. 2018:39(2):119-77. doi:10.1093/eurheartj/ehx393.
Об авторах
В. Э. ОлейниковРоссия
Валентин Эливич Олейников — доктор медицинских наук, профессор, заведующий кафедрой "Терапия".
Пенза
Конфликт интересов:
нет
А. В. Голубева
Россия
Алена Владимировна Голубева — кандидат медицинских наук, старший преподаватель кафедры "Терапия".
Пенза
Конфликт интересов:
нет
Ю. А. Барменкова
Россия
Юлия Андреевна Барменкова — кандидат медицинских наук, ассистент кафедры "Терапия".
Пенза
Конфликт интересов:
нет
А. В. Кулюцин
Россия
Алексей Валерьевич Кулюцин — кандидат медицинских наук, заведующий отделением неотложной кардиологии с палатой реанимации и интенсивной терапии.
Пенза
Конфликт интересов:
нет
Н. В. Бурко
Россия
Надежда Валерьевна Бурко — кандидат медицинских наук, доцент кафедры "Терапия".
Пенза
Конфликт интересов:
нет
М. В. Лукьянова
Россия
Марина Владимировна Лукьянова — кандидат медицинских наук, доцент кафедры "Терапия".
Пенза
Конфликт интересов:
нет
Н. А. Донецкая
Россия
Наталья Александровна Донецкая — заведующий отделением лучевой диагностики.
Пенза
Конфликт интересов:
нет
Дополнительные файлы
Рецензия
Для цитирования:
Олейников В.Э., Голубева А.В., Барменкова Ю.А., Кулюцин А.В., Бурко Н.В., Лукьянова М.В., Донецкая Н.А. Деформационные характеристики миокарда и вагосимпатический баланс при различных вариантах течения постинфарктного периода на фоне высокодозовой терапии аторвастатином. Российский кардиологический журнал. 2022;27(12):5078. https://doi.org/10.15829/1560-4071-2022-5078
For citation:
Oleinikov V.E., Golubeva A.V., Barmenkova Yu.A., Kulyutsin A.V., Burko N.V., Lukyanova M.V., Donetskaya N.A. Myocardial strain parameters and autonomic balance in various variants of the postinfarction course in patients receiving high-dose atorvastatin therapy. Russian Journal of Cardiology. 2022;27(12):5078. (In Russ.) https://doi.org/10.15829/1560-4071-2022-5078
JATS XML

















































