Перейти к:
Клинико-морфологическое и молекулярно-биологическое исследование миокарда у пациентов с COVID-19
https://doi.org/10.15829/1560-4071-2022-4810
Аннотация
Наличие коронавирусного миокардита остается спорным, несмотря на повышение сердечного тропонина и натрийуретического пептида у многих пациентов.
Цель. Оценить морфологические изменения миокарда у пациентов, умерших от новой коронавирусной инфекции (COVID-19), и сопоставить их с прижизненным уровнем сердечных биомаркеров.
Материал и методы. Проанализировано 420 историй болезни и 77 аутопсий умерших от COVID-19. В 15 из 77 случаев (19%) с гистологически заподозренным миокардитом выполнялось иммуногистохимическое исследование миокарда с антителами к CD3, CD45, CD8, CD68, CD34, Ang1, VWF, VEGF, HLA-DR, MНC1, C1q, VP1 энтеровирусов, а у 8 пациентов с иммуногистохимически подтвержденным миокардитом (10% от 77) — полимеразная цепная реакция на SARS-CoV-2.
Результаты. Кровоизлияния, тромбоз интрамуральных артерий, некоронарогенные некрозы, инфаркт миокарда и лимфоцитарный миокардит были выявлены в 43, 10, 17, 19 и 10% случаев, соответственно, без присутствия последовательностей генов N и E коронавируса в миокарде. Определялись дисплазия, гиперплазия и гипертрофия эндотелия сосудов, экспрессия Ang1, VWF, VEGF, MНC1, C1q, VP1 энтеровирусов в 100, 100, 87, 100, 75 и 62% случаев миокардита, соответственно. Не было выявлено значимых корреляций между воспалительными биомаркерами и миокардитом.
Заключение. Основным морфологическим проявлением COVID-19 в миокарде является так называемый эндотелиит с дисплазией и активацией эндотелиоцитов, приводящий к кровоизлияниям, тромбозу интрамуральных артерий и некрозам. Убедительные доказательства непосредственного участия коронавируса в индукции миокардита отсутствуют.
Ключевые слова
Для цитирования:
Митрофанова Л.Б., Макаров И.А., Рунов А.Л., Вонский М.С., Данилова И.А., Сидорин В.С., Моисеева О.М., Конради А.О. Клинико-морфологическое и молекулярно-биологическое исследование миокарда у пациентов с COVID-19. Российский кардиологический журнал. 2022;27(7):4810. https://doi.org/10.15829/1560-4071-2022-4810
For citation:
Mitrofanova L.B., Makarov I.A., Runov A.L., Vonsky M.S., Danilova I.A., Sidorin V.S., Moiseva O.M., Conradi A.O. Clinical, morphological and molecular biological examination of the myocardium in COVID-19 patients. Russian Journal of Cardiology. 2022;27(7):4810. (In Russ.) https://doi.org/10.15829/1560-4071-2022-4810
С первых дней пандемии новой коронавирусной инфекции (COVID-19) появились сообщения об увеличении уровня сердечных биомаркеров (сердечного тропонина и натрийуретических пептидов) у госпитализированных пациентов. Со временем стало очевидным, что повреждение миокарда, оцениваемое на основании анализа биомаркеров, а именно на основании повышения концентрации сердечного тропонина, связано с тяжелым течением инфекции и неблагоприятным прогнозом [1]. В то время как ранние рекомендации различных кардиологических обществ [2][3] предлагали ограничить тестирование сердечных биомаркеров пациентам с COVID-19 и симптомами острого коронарного синдрома или сердечной недостаточности, многие медицинские учреждения продолжали использовать биомаркеры повреждения миокарда как простой и недорогой инструмент для стратификации риска.
Частота повреждения миокарда среди госпитализированных пациентов с COVID-19 варьирует в широких пределах от 13 до 41%, что обуславливает высокую смертность от сердечно-сосудистых осложнений [4]. Тем не менее частота развития миокардитов по данным текущих публикаций по-прежнему остается весьма неопределенной [5]. При этом дифференциальный диагноз причины повышения уровня тропонина при COVID-19 не всегда очевиден. Наличие миокардита не всегда может быть подтверждено прижизненными исследованиями, даже магнитнорезонансной томографией, что делает крайне актуальным вопрос морфологической диагностики для оценки истинных механизмов поражения сердца.
Цель исследования: оценить морфологические изменения миокарда у пациентов, умерших от COVID-19, и сопоставить их с прижизненным уровнем сердечных биомаркеров.
Материал и методы
В анализ включено 420 историй болезни пациентов с COVID-19, лечившихся в ФГБУ “НМИЦ им. В.А. Алмазова” летом 2020г, и 77 аутопсийных исследований умерших от COVID-19 в тот же период. У всех больных вирусная инфекция была подтверждена с помощью полимеразной цепной реакции (ПЦР) в мазке из носа и зева при жизни и в тканях трахеи, бронха и легких посмертно (нативный материал). Всем пациентам была проведена компьютерная томография (на томографе Somatom Defenition 128 срезов Siemens) и стандартное лабораторное обследование с оценкой клинического анализа крови, уровня С-реактивного белка, прокальцитонина, Д-димера, ферритина и тропонина I. Также проводились электрокардиографическое и эхокардиографическое исследования. Среди умерших пациентов было 34 женщины и 43 мужчины в возрасте от 41 до 90 лет. Все больные умерли от острого респираторного дистресс синдрома на фоне двусторонней сливной вирусной бронхопневмонии на сроке от 1 до 57 сут. после госпитализации. В каждом случае забирался миокард из стенок 4 камер сердца и межжелудочковой перегородки. Проводилось традиционное гистологическое исследование миокарда с окраской гематоксилином и эозином, а в случаях выявления негнойной воспалительной инфильтрации миокарда (в 15 из 77) — иммуногистохимический анализ с антителами к CD3, CD45, CD8, CD68, CD34, Ang1, фактору фон Виллебранда (VWF), VEGF, HLA-DR, MНC1, C1q, VP1 энтеровирусов. Морфометрический анализ включал подсчет среднего количества клеток воспалительного инфильтрата на 1 мм2 и оценку экспрессии HLA-DR, MНC1, C1q, Ang1, VWF и VEGF в баллах (1 — экспрессия на единичных клетках и сосудах, 2 — на 1/3 клеток, 3 — на 1/2-2/3 площади препарата, 4 — на всех исследуемых клетках).
В случаях вирусного миокардита, подтвержденных иммуногистохимическим анализом (в 8 случаях), содержание геномной рибонуклеиновой кислоты (РНК) вируса SARS-CoV-2 в образцах оценивали, используя двухшаговый метод цифровой ПЦР после обратной транскрипции (ОТ-цПЦР) в соответствии с рекомендациями СDС центра Китая для гена N и клиники Charite для гена E [6, 7]. Препараты РНК выделяли из пяти последовательных срезов FFPE блоков ткани миокарда левого желудочка, используя наборы AllPrep DNA/RNA FFPE Kit (QiaGen, 80234). Реакцию обратной транскрипции проводили с использованием RevertAid H Minus First Strand cDNA Synthesis Kit (ThermoScientific, K1632) со специфическими праймерами и случайными олигогексамерами. Реакцию цифровой капельной ПЦР проводили с использованием смеси ddPCR Supermix for Probes (Bio-Rad, #1863026). В качестве положительного контроля выделения применяли ОТ-цПЦР мРНК гена β-актина.
Статистический анализ проводился с помощью Statistica v.10 software (StatSoft, Россия). Для нормальных распределений значимость различий в количественных характеристиках интерпретировали с использованием t-критерия Стьюдента при требуемом уровне значимости р<0,05. Корреляционный анализ был выполнен с помощью U-критерия Манна-Уитни и последующей оценки достоверности с помощью таблицы критических значений U-критерия при требуемом уровне значимости р<0,05.
Результаты
Средний возраст пациентов, лечившихся в Центре от коронавирусной инфекции, составил 66,7±1,1 лет, умершие пациенты были на 10 лет старше выживших (табл. 1). Наиболее частыми сопутствующими заболеваниями были артериальная гипертензия, ишемическая болезнь сердца (ИБС) и сахарный диабет.
Таблица 1
Клинические и лабораторные показатели пациентов с COVID-19 и у пациентов с подтвержденным иммуногистохимическим диагнозом миокардита
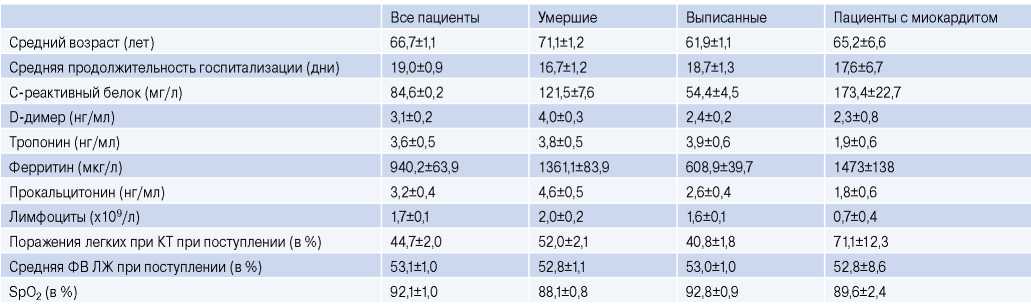
Сокращения: КТ — компьютерная томография, ЛЖ — левый желудочек, ФВ — фракция выброса.
При анализе анамнестических данных ИБС документирована у 43 умерших пациентов (56%), у 49 (64%) выявлена артериальная гипертензия, у 20 (26%) — сахарный диабет, у 9 (12%) — хроническая цереброваскулярная болезнь с острым нарушением мозгового кровообращения, у 12 (16%) — онкологические заболевания, у 3 (4%) — хроническая обструктивная болезнь легких, у 1 — хроническая ревматическая болезнь сердца (2%), у 1 (2%) — ВИЧинфекция. Среднее количество койко-дней у умерших пациентов было 14,7±2,5.
У умерших и выживших пациентов отмечены значимые различия по следующим показателям: С-реактивный белок, D-димер, ферритин, прокальцитонин, процент поражения лёгочной паренхимы при компьютерной томографии (t критерий Стьюдента при требуемом уровне значимости р<0,05). У большинства больных наблюдалась лимфопения, как среди выписанных, так и среди умерших.
У большинства больных с миокардитами (75%), подтвержденными иммуногистохимическим анализом, выявлено повышение тропонина I. Эхокардиографическое исследование проводилось только в 25% случаев. Лимфопению мы наблюдали в 7 из 8 случаев вирусного миокардита. Статистически достоверно процент поражения легочной ткани по данным компьютерной томографии у пациентов с миокардитом был выше, чем у всех пациентов (71,1±12,3% vs 44,7±2,0% при р<0,05%).
При гистологическом исследовании сердца у 33 (43%) больных наблюдались множественные кровоизлияния в миокард (рис. 1 а), у 8 (10%) — тромбы в интрамуральных артериях, у 13 (17%) — некоронарогенные некрозы, у 7 (9%) — выраженный отек стромы с отложением фибрина в интерстиции (рис. 1 б), у 11 (14%) — скопления макрофагов в строме, у 3 (4%) — гнойничковый миокардит (рис. 1 в), у 4 (5%) — инфильтративный васкулит, у 1 (1%) — лимфоцитарный перикардит, у 7 (9%) — фрагментация мышечных волокон, у 4 (5%) — лейкоцитарные стазы, у 8 (10%) — очаговое плазматическое пропитывание стенок интрамуральных артерий, у 20 (26%) — выраженная гипертрофия миокарда, у 2 (3%) — липоматоз, у 14 (18%) — постинфарктные рубцы, у 5 (6%) — геморрагический инфаркт миокарда (ИМ) (рис. 1 г), у 10 (13%) — ишемический ИМ (рис. 1 д; в 1 случае замедленной организации). Лимфоцитарный активный миокардит был заподозрен в 15 (19%) случаях (рис. 1 е).

Рис. 1. Морфологическое исследование миокарда пациентов с COVID-19. (а) кровоизлияние в строму (указаны красной стрелкой), фрагментация мышечных волокон (указана синей стрелкой); гематоксилин и эозин, х200. (б) отек стромы миокарда с выпотом фибрина (указано жёлтыми стрелками); гематоксилин и эозин, х100. (в) гнойничковый миокардит с инфильтрацией нейтрофильными лейкоцитами (указано синей стрелкой), окруженными Т активированными лимфоцитами (коричневое окрашивание CD3 по периферии гнойничка); х200. (г) геморрагический ИМ с полным кариолизисом; гематоксилин и эозин, х100. (д) ишемический ИМ; гематоксилин и эозин, х100. (е) лимфоцитарный миокардит. Агрессивное вклинение лимфоцитов в кардиомиоциты (указано зелёными стрелками); гематоксилин и эозин, х200. (ж, з, и) крупные, полиморфные клетки в зоне сосудов в миокарде (указаны черными стрелками) с фрагментацией мышечных волокон (ж) и перикарде (з, и); гематоксилин и эозин, х200; х400.
Примечание: цветное изображение доступно в электронной версии журнала.
При этом в 9 из 15 случаев наблюдались нарушения ритма и проводимости (фибрилляция предсердий в 4 случаях, предсердная экстрасистолия в 1 случае, желудочковая экстрасистолия в 1 случае, неполная блокада правой ножки пучка Гиса — в 4, полная блокада передне-верхнего разветвления левой ножки пучка Гиса — в 2). У 1 пациента электрокардиографическое исследование не успели выполнить (табл. 2).
Таблица 2
Клинико-лабораторные показатели умерших пациентов с гистологическим диагнозом миокардита
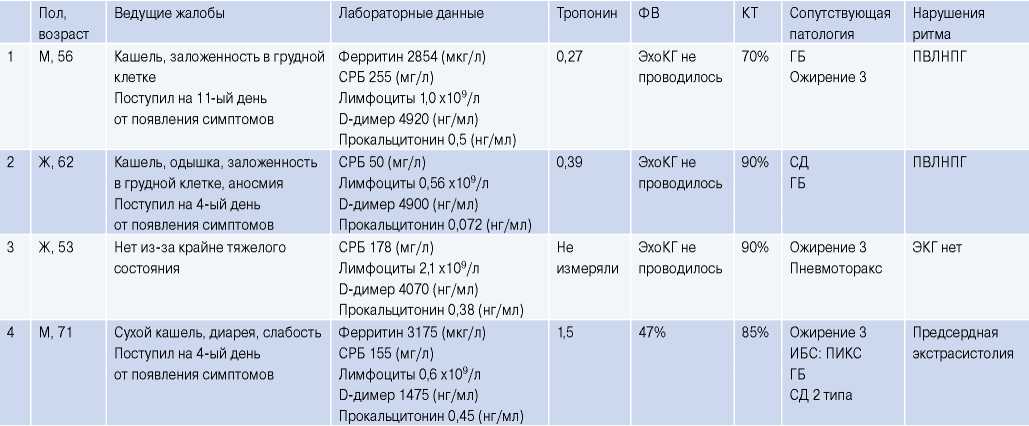
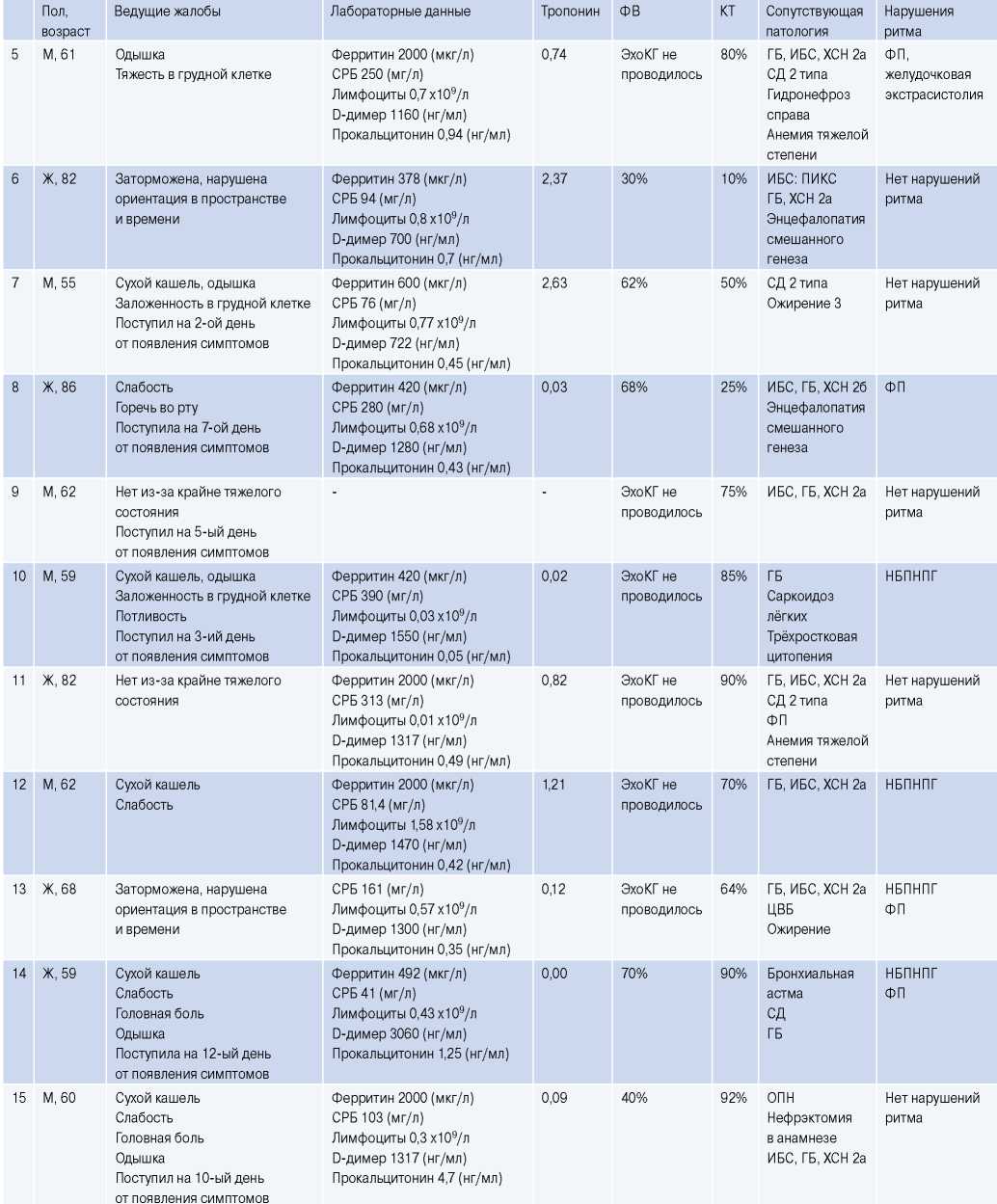
Сокращения: ГБ — гипертоническая болезнь, ИБС — ишемическая болезнь сердца, КТ — компьютерная томография, НБПНПГ — неполная блокада правой ножки пучка Гиса, ОПН — острая почечная недостаточность, ПВЛНПГ — полная блокада передне-верхнего разветвления левой ножки пучка Гиса, ПИКС — постинфарктный кардиосклероз, СД — сахарный диабет, СРБ — C-реактивный белок, ФВ — фракция выброса, ФП — фибрилляция предсердий, ХСН — хроническая сердечная недостаточность, ЭКГ — электрокардиограмма, ЭхоКГ — эхокардиография, ЦВБ — цереброваскулярная болезнь.
В 43 случаях (56%) в миокарде и перикарде были выявлены крупные полиморфные клетки, располагающиеся в зоне сосудов (рис. 1 ж, з, и).
При иммуногистохимическом исследовании лимфоцитарный активный миокардит в соответствии с международными критериями [8] был подтвержден только в 8 (53%) из 15 случаев, что составило 10% от общего числа умерших пациентов (табл. 3).
При этом в 7 из 8 случаев доказанного миокардита наблюдались нарушения ритма и проводимости.
В группе пациентов с подозрением на лимфоцитарный миокардит не было выявлено значимых корреляций между воспалительными биомаркерами и наличием или отсутствием иммуногистохимически подтвержденного миокардита (табл. 4, рис. 2).
Таблица 3
Морфологические показатели пациентов с иммуногистохимическим диагнозом вирусного миокардита

Сокращения: КМЦ — кардиомиоцит, МИМА — мелкие интрамиокардиальные артерии, ОИМ — острый инфаркт миокарда, Ang — angiopoietin, CD — cluster of differentiation, HLA-DR — Human Leukocyte Antigen — DR isotype, MНC1 — major histocompatibility complex, VEGF — vascular endothelial growth factor, VWF — von Willebrand factor.
Таблица 4
Корреляционный анализ между воспалительными биомаркерами и наличием или отсутствием иммуногистохимически подтвержденного миокардита
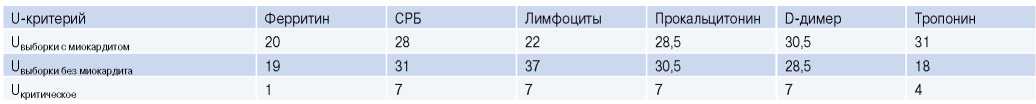
Сокращение: СРБ — C-реактивный белок.
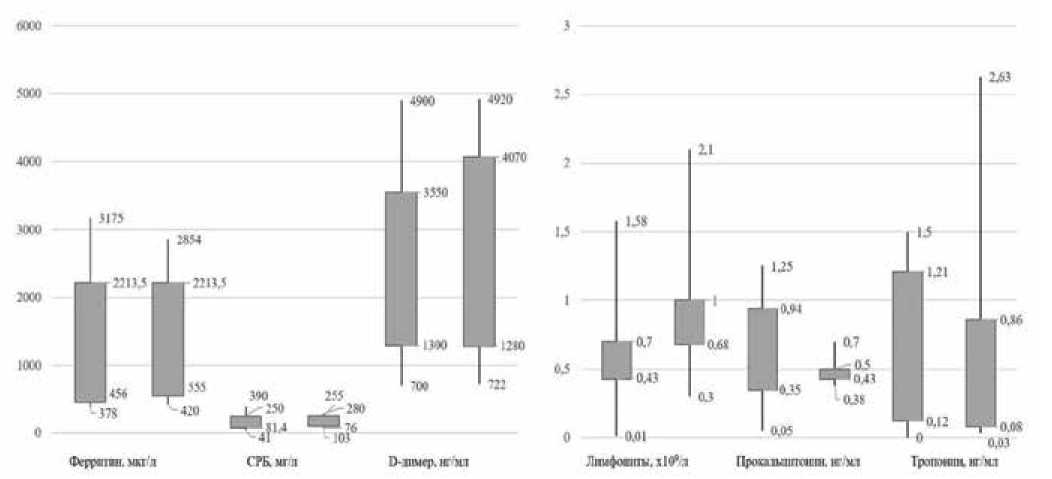
Рис. 2. Основные статистические показатели клинико-лабораторных изменений у пациентов с гистологическим подозрением на лимфоцитарный миокардит.
Примечание: столбцы диаграммы слева в парах отражают характеристики выборки биомаркеров у пациентов с иммуногистохимически подтверждённым миокардитом, столбцы справа — характеристики выборки неподтвержденного иммуногистохимическим исследованием миокардита. Цифры над верхними вертикальными линиями отображают максимальные значения данных выборок, цифры под нижними вертикальными линиями — минимальные значения. Верхние цифры справа у широких столбцов отображают верхний квартиль выборки, нижние цифры справа у широких столбцов — нижний квартиль выборки.
Сокращение: СРБ — С-реактивный белок.
При иммуногистохимическом исследовании в 6 из 8 случаев была выявлена реакция гуморального иммунитета с экспрессией C1q-компонента комплимента (рис. 3 а), а в 5 из 8 — наличие капсидного VP1-антигена энтеровирусов преимущественно в стенках сосудов (рис. 3 б). На крупных полиморфных клетках в зоне сосудов определялась экспрессия CD34 (рис. 3 в). Только часть из этих клеток была макрофагами с экспрессией CD68 (рис. 3 г). Повышенное количество их (≥14/мм2) определялось в 3 из 8 случаев. При гистологическом и иммуногистохимическом исследовании мы не обнаружили выраженной диффузной лимфоцитарной инфильтрации миокарда. Максимальные очаговые инфильтраты насчитывали 21-37 CD3+T-лимфоцитов/мм2. Ни в одном случае миокардита не было выявлено CD8+T-лимфоцитов. Во всех 8 случаях лимфоцитарного миокардита наблюдалась экспрессия фактора фон Виллебранда (VWF) на эндотелии сосудов (рис. 3 ж), ангиопоэтина Ang1 — на эндотелии и в саркоплазме кардиомиоцитов (рис. 3 з, и). Экспрессия сосудистого ростового фактора VEGF на эндотелии и в мышечных волокнах наблюдалась в 4 случаях, только на эндотелии — в 3 и отсутствовала в 1 случае (рис. 3 д, е).

Рис. 3. Иммуногистохимическое исследование миокарда пациентов с COVID-19. (а) экспрессия C1q — компонента комплемента на сосудах и клетках инфильтрата. (б) выраженная экспрессия VP1 энтеровирусов на сосудах и умеренная — в саркоплазме кардиомиоцитов. (в) экспрессия CD34 на эндотелии, в т.ч. на гипертрофированных клетках (указаны желтыми стрелками). (г) экспрессия CD68 на макрофагах. При этом преобладают CD68”-“ эндотелиоциты (указаны желтыми стрелками). (д, е) экспрессия VEGF на эндотелии, его гипертрофированных клетках и в мышечном волокне. (ж) экспрессия фактора фон Виллебранда (VWF) на клетках эндотелия. (з, и) экспрессия Ang1 в эндотелии сосудов; гранулярная экспрессия в саркоплазме кардиомиоцитов; (коричневое окрашивание) х200; х400.
Примечание: цветное изображение доступно в электронной версии журнала.
В целом у умерших больных с коронавирусной инфекцией вне зависимости от наличия или отсутствия миокардита мы выявили экспрессию Ang1, VEGF, VWF. Причем Ang1 и VEGF в некоторых случаях экспрессировались не только в эндотелии, но и кардиомиоцитах.
Таким образом, наиболее частыми находками в сердце были активированный, пролиферирующий, гипертрофированный эндотелий сосудов и кровоизлияния в миокард. Лимфоцитарный миокардит был выявлен всего в 10% случаев (из 77). В 7 из 8 случаев он сопровождался нарушениями ритма и повышением уровня тропонина.
Ранее ФГУП “ВНИИМ им. Д. И. Менделеева” было принято участие в пилотных сличениях на высшем уровне точности Консультативного комитета по количеству вещества: метрология для химии и биологии CCQM-P199b “Измерения числа копий РНК SARS-CoV-2” [9]. Результаты этих сличений подтвердили, что реализованная нами методика цифровой капельной ПЦР после обратной транскрипции обеспечивает возможность достоверного измерения концентрации копий последовательностей в составе генома SARS-CoV-2 на уровне 10 мкл-1. Однако в результате исследований препаратов РНК, выделенных из FFPE препаратов ткани миокарда левого желудочка, нами не было обнаружено присутствия последовательностей генов N и E коронавируса.
Обсуждение
Анализируя данные аутопсийного исследования, нами показано, что самыми частыми изменениями при COVID-19 в миокарде являются дисэндотелиоз или эндотелиит сосудов (гипертрофия, гиперплазия,
дисплазия и повреждение эндотелия) с последующими кровоизлияниями. Varga Z, et al. [10] также описывают признаки эндотелиита в таких органах, как легкие, сердце, почки и кишечник, считая его прямым следствием вирусного поражения и воспалительной реакции в организме хозяина. По мнению авторов, COVID-19-эндотелиит может объяснить системные микроциркуляторные нарушения, возникающие в различных органах. На сегодняшний день известно, что SARS-CoV-2 — это вирус одноцепочечной РНК, чей S-белок внешней мембраны связывается с рецептором ангиотензинпревращающего фермента 2 (АПФ2) [11]. АПФ2 служит главным регулятором ренин-ангиотензиновой системы, метаболизируя сосудосуживающий и провоспалительный ангиотензин II (Ang II) до сосудорасширяющего пептида ангиотензина. Попав внутрь клетки, вирус использует механизм хозяина для трансляции РНК в полипептиды, включая РНК-зависимую РНК-полимеразу, которую вирус использует для репликации своей собственной РНК. После синтеза структурных белков и сборки частиц новый вирус высвобождается из клетки путем
экзоцитоза. В рамках активации врожденного иммунного ответа пораженные клетки-хозяева могут повреждаться [12]. АПФ2 экспрессируется в ряде тканей, включая сердце, легкие, гладкие мышцы кишечника, печень, почки и иммунные клетки. Вызванное вирусом подавление АПФ2 приводит к ослаблению его противовоспалительной функции и усилению провоспалительного эффекта ангиотензина II, что особенно негативно влияет на пациентов с артериальной гипертензией, ИБС и сахарным диабетом, которые в основном представлены в нашей выборке. Однако рецепторы АПФ2, наряду с легкими, в первую очередь экспрессируются эндотелиальными клетками, чем и обусловлена высокая тропность вируса к эндотелию. Интересно, что SARS-CoV-2 может напрямую инфицировать сконструированные органоиды кровеносных сосудов человека in vitro [13].
Ранее в исследовании аутопсийного материала пациентов, умерших от тяжелого острого респираторного синдрома, показано, что 7 (35%) из 20 сердец являются носителями коронавируса SARS-CoV [14][15]. Тем не менее на сегодняшний день существует лишь несколько работ, в которых выполнена идентификация геномной РНК SARS-CoV-2 в ткани миокарда [14][16].
Деградация одноцепочечной РНК при формалиновой фиксации тканей обычно более выражена, чем деградация дезоксирибонуклеиновой кислоты, что может приводить к ложноотрицательным результатам при поиске низкокопийных РНК-мишеней в подобных препаратах. Кроме того, исследование содержания нуклеиновых кислот в FFPE образцах было лимитировано ограниченным количеством материала. Для оценки количества материала, выделенного из FFPE блоков и пригодного для цПЦР (в т.ч. ОТ-цПЦР), выполняли измерения концентрации копий последовательности в составе однокопийного гена β-глобина и в составе мРНК гена β-актина. Концентрация копий последовательности гена β-глобина в исследованных образцах составила 70±40 мкл-1, мРНК β-актина — 3500±1400 мкл-1.
Учитывая, что среднее содержание РНК на клетку составляет 20 пг (пикограмм), и принимая во внимание результаты оценки числа копий геномов, содержание пригодной для измерений методом цПЦР РНК в выделенном материале составляет 700±400 пг/мкл. Согласно результатам Lindner D, et al. [17], в 33% аутопсийных образцах от пациентов с подтвержденным SARS-CoV-2 вирусная нагрузка составила <1 тыс. копий на микрограмм выделенной тотальной РНК, тогда как нагрузка >80 тыс. копий на микрограмм РНК была обнаружена только для 20% образцов, т.е. типичное содержание РНК коронавируса в препарате составляет порядка 0,001 копий на пикограмм выделенной тотальной РНК. В 4 из 8 исследованных нами методом ОТ-цПЦР препаратах амплификацию наблюдали только в одной микрокапле из 15-20 тыс., что не позволило вынести заключение о присутствии РНК коронавируса. Однако данный результат может расцениваться как ложноотрицательный вследствие недостаточного количества РНК, доступного для проведения исследования.
В то же время в отчете о 104 пациентах с инфекцией COVID-19, у которых развилась острая сердечная недостаточность и которым была проведена эндомиокардиальная биопсия, только у 5 был положительный результат на геном SARS-CoV-2 в ткани миокарда на фоне типичных признаков миокардита, включая выраженное воспаление, микрососудистые изменения, тромбоз и некроз миокарда [18].
В результате нашего исследования миокардит с помощью иммуногистохимического анализа был подтвержден только у 10% пациентов (из 77), однако ОТ-цПЦР исследование не подтвердило достоверного присутствия РНК вируса SARS-CoV-2, которое бы свидетельствовало о том, что миокардит вызван именно коронавирусной инфекцией. К тому же в упомянутых выше 4 случаях была определена выраженная экспрессия VP1 энтеровирусов, преобладающая в сосудистых стенках (в течение 15 лет в ФГБУ “НМИЦ им. В.А. Алмазова” используется методика иммуногистохимического исследования миокарда с антителом к VP1-энтеровирусов (DAKO), которая была отработана параллельно с ПЦР в биоптатах миокарда). На наш взгляд, возможна активация латентной энтеровирусной инфекции, описанной у пациентов с сердечно-сосудистыми заболеваниями, например, с ИБС [19], как вследствие SARS-CoV-2 инфекции либо опосредовано за счет нарушения иммунного ответа. Кроме того, доказано, что эндогенные протеазы коронавирусов и энтеровирусов имеют сходство по своей структуре и функциям. Эти протеазы обрабатывают свои вирусные полипротеины, и, таким образом, лекарственные средства, которые связываются с активным сайтом, потенциально могут воздействовать на обе вирусные группы [20].
Weckbach LT, et al. [5] не обнаружили РНК SARS-CoV-2 ни в одной эндомиокардиальной биопсии с помощью количественной ПЦР в реальном времени, но выявили повышенное количество макрофагов.
Макрофаги являются ключевым компонентом врожденной иммунной системы и основным источником провоспалительных цитокинов. Их активация осуществляется дезинтегрином и доменом металлопротеиназы 17 (ADAM-17), трансмембранной протеазой, которая также отвечает за протеолиз и отщепление эктодомена ACE2 [21]. Наше исследование показало повышенное количество макрофагов при миокардите только в 3 из 8 случаев.
Ни в одном случае миокардита мы не выявили выраженную диффузную лимфоцитарную инфильтрацию, а CD8+T-киллеры вовсе отсутствовали в миокарде в отличие от описаний других авторов [22]. Возможно, это связано с лимфопенией, которая была диагностирована у большинства пациентов. Известно, что лимфопения возникает на ранней стадии заболевания и является плохим прогностическим фактором. Она потенциально связана с уменьшением количества CD4+ и некоторых CD8+Т-клеток, что приводит к дисбалансу врожденного/приобретенного иммунного ответа, задержке выведения вируса и гиперстимуляции макрофагов и нейтрофилов. Соответствующая активация пути интерферона I типа имеет решающее значение для ослабления вируса и сбалансированного иммунного ответа. Устойчивая активация иммунной системы у предрасположенных пациентов, таких как пожилые люди и пациенты с сердечно-сосудистыми заболеваниями, может привести к гемофагоцитозоподобному синдрому с неконтролируемым усилением продукции цитокинов, что приводит к полиорганной недостаточности и смерти.
На наш взгляд, характерным морфологическим признаком COVID-19 является дисплазия эндотелиальных клеток, которая, очевидно, обусловлена нахождением в них вирусных частиц. Действительно, электронная микроскопия показала частицы, соответствующие вирусу SARS-CoV-2 в сердечной эндотелиальной клетке, но не в кардиомиоцитах [23]. Кровоизлияния, тромбозы и некрозы миокарда представляют последствия дисфункции эндотелия.
У больных с коронавирусной инфекцией вне зависимости от наличия или отсутствия миокардита мы выявили экспрессию Ang1, VEGF, VWF. Причем Ang1 и VEGF в некоторых случаях экспрессировались не только в эндотелии, но и кардиомиоцитах. VEGF и Ang1 являются двумя основными ангиогенными факторами, которые исследуются для лечения ИМ. Известно, что кардиоспецифическая, вызванная гипоксией, коэкспрессия VEGF и Ang1 улучшает перфузию и функцию сердца за счет индукции ангиогенеза и пролиферации кардиомиоцитов, активации путей выживания и уменьшения апоптоза клеток [24]. Причем эта гипоксия может быть как следствием ишемии [25], так и быть гипоксемической [26].
Известно, что у мышей, подвергшихся гипоксии, повышение экспрессии VWF сопровождается наличием тромбов в сердце и легких [27], как и при COVID-19. VWF играет ключевую роль в адгезии и агрегации тромбоцитов в коронарных артериях со стенозирующими и нестабильными атеросклеротическими бляшками. Многочисленные исследования показали, что VWF является значимым прогностическим фактором неблагоприятных сердечных событий, включая смерть. Он повышается во время острого коронарного синдрома и служит не только маркером, но и фактически важным эффектором в патогенезе ИМ. Центральная роль VWF в тромбообразовании сделала его многообещающей целью для исследований новых антитромбозных методов лечения [28].
ADAMTS13 — фермент, расщепляющий VWF, снижает рекрутирование лейкоцитов и тромбоцитов и, таким образом, снижает тромбообразование и интенсивность воспалительной реакции. Рекомбинантный человеческий ADAMTS13 (rhADAMTS13) является новым кандидатом лекарственного препарата от ишемии/реперфузионного повреждения и показал краткосрочные преимущества на мышиных моделях повреждения миокарда, но долгосрочные результаты не исследовались [29].
У большинства пациентов с доказанными миокардитами мы наблюдали нарушения сердечного ритма в виде неполной блокады правой ножки пучка Гиса, полной блокады передне-верхнего разветвления левой ножки пучка Гиса, фибрилляции или экстрасистолии предсердий, у одного — желудочковую экстрасистолию (в ассоциации с острым ИМ). На наш взгляд, эти нарушения ритма нельзя объяснить только наличием миокардита. Описаны несколько причин: 1) гипокалиемия или гипомагниемия в результате самого заболевания (например, диареи), особенно, у тяжелобольных, либо при определенных видах лечения, таких как мочегонные средства; 2) фармакотерапевтические препараты, перепрофилированные для лечения COVID-19 с риском удлинения интервала QT и torsades de pointes; 3) за счет прямого электрофизиологического воздействия цитокинов на миокард [30]; 4) быстрое ухудшение функции почек и электролитные нарушения [31].
Теперь мы знаем, что люди с наибольшим риском смерти — это пожилые люди (в нашем исследовании средний возраст умерших был 71 год), с сопутствующими сердечно-сосудистыми заболеваниями. Острые коронарные события, как в наших 19% случаев, могут быть результатом резкого увеличения потребности миокарда в кислороде, вызванного инфекцией, аналогично ИМ 2 типа. С другой стороны, циркулирующие цитокины, высвобождаемые во время тяжелого системного воспалительного стресса, могут привести к нестабильности и разрыву атеросклеротической бляшки. Точно так же пациенты с сердечной недостаточностью склонны к декомпенсации гемодинамики во время стресса от тяжелых инфекционных заболеваний [32].
Клеточные и экспериментальные модели инфекции SARS-CoV-2 на животных, в дополнение к транскрипционному и сывороточному профилированию пациентов с COVID-19, неизменно выявляли уникальный и несоответствующий воспалительный ответ. Этот ответ определяется низкими уровнями интерферонов I и III типов в сравнении с повышенными хемокинами и высокой экспрессией IL-6. Предполагается, что снижение врожденной противовирусной защиты в сочетании с обильной выработкой воспалительных цитокинов являются определяющими и движущими чертами COVID-19 [33].
Заключение
Наше исследование показало, что основным морфологическим проявлением COVID-19 в миокарде является так называемый эндотелиит с дисплазией и активацией эндотелиоцитов, приводящий к кровоизлияниям, тромбозу интрамуральных артерий и некрозам. Убедительные доказательства непосредственного участия коронавируса в индукции миокардита отсутствуют, что в целом подтверждает теорию патогенеза тяжёлого течения коронавирусной инфекции, основанную на преимущественно иммунном поражении эндотелия и микротромбозах. У большинства пациентов с доказанными миокардитами мы наблюдали нарушения сердечного ритма в виде неполной блокады правой ножки пучка Гиса, полной блокады передне-верхнего разветвления левой ножки пучка Гиса, фибрилляции или экстрасистолии предсердий, у одного — желудочковую экстрасистолию (в ассоциации с острым ИМ). Не было выявлено значимых корреляций между воспалительными биомаркерами и морфологически подтвержденным миокардитом.
Отношения и деятельность. Исследование выполнено при финансовой поддержке Министерства науки и высшего образования Российской Федерации (Соглашение № 075-15-2020-901 от 13.11.2020).
Список литературы
1. Bularga A, Chapman AR, Mills NL. Mechanisms of Myocardial Injury in COVID-19. Clin Chem. 2021;67(8):1044-6. doi:10.1093/clinchem/hvab111.
2. European Society of Cardiology. ESC Guidance for the diagnosis and management of cardiovascular disease during the COVID-19 pandemic. Last updated June 2020. https://www.escardio.org/The-ESC/Press-Office/Press-releases/ESC-Guidance-forthe-Diagnosis-and-Management-of-Heart-Disease-during-COVID-19
3. Chapman AR, Bularga A, Mills NL. High-Sensitivity Cardiac Troponin Can Be an Ally in the Fight Against COVID-19. Circulation. 2020;141(22):1733-5. doi:10.1161/CIRCULATIONAHA.120.047008.
4. Friedrich MG, Cooper LT. What we (don’t) know about myocardial injury after COVID-19. Eur Heart J. 2021;42(19):1879-82. doi:10.1093/eurheartj/ehab145.
5. Weckbach LT, Curta A, Bieber S, et al. Myocardial Inflammation and Dysfunction in COVID-19-Associated Myocardial Injury. Circ Cardiovasc Imaging. 2021;14(1):e012220. doi:10.1161/CIRCIMAGING.120.011713.
6. Suo T, Liu X, Feng J, et al. ddPCR: a more accurate tool for SARS-CoV-2 detection in low viral load specimens. Emerg Microbes Infect. 2020;9(1):1259-68. doi:10.1080/22221751.2020.1772678.
7. Corman VM, Landt O, Kaiser M, et al. Detection of 2019 novel coronavirus (2019nCoV) by real-time RT-PCR. Euro Surveill. 2020;25(3):2000045. doi:10.2807/1560-7917.ES.2020.25.3.2000045.
8. Cooper LT, Baughman KL, Feldman AM, et al. The role of endomyocardial biopsy in the management of cardiovascular disease: a scientific statement from the American Heart Association, the American College of Cardiology, and the European Society of Cardiology. Endorsed by the Heart Failure Society of America and the Heart Failure Association of the European Society of Cardiology. J Am Coll Cardiol. 2007;50(19):1914-31. doi:10.1016/j.jacc.2007.09.008.
9. BIPM. National Measurement Institutes demonstrate high accuracy reference measurement system for SARS-CoV-2 testing. https://www.bipm.org/en/-/2020-nmicovid (15.11.2021).
10. Varga Z, Flammer AJ, Steiger P, et al. Endothelial cell infection and endotheliitis in COVID19. Lancet. 2020;395(10234):1417-8. doi:10.1016/S0140-6736(20)30937-5.
11. Gheblawi M, Wang K, Viveiros A, et al. Angiotensin-Converting Enzyme 2: SARSCoV-2 Receptor and Regulator of the Renin-Angiotensin System: Celebrating the 20th Anniversary of the Discovery of ACE2. Circ Res. 2020;126(10):1456-74. doi:10.1161/CIRCRESAHA.120.317015.
12. Liu PP, Blet A, Smyth D, Li H. The Science Underlying COVID-19: Implications for the Cardiovascular System. Circulation. 2020;142(1):68-78. doi:10.1161/CIRCULATIONAHA.120.047549.
13. Shi S, Qin M, Shen B, et al. Association of Cardiac Injury With Mortality in Hospitalized Patients With COVID-19 in Wuhan, China. JAMA Cardiol. 2020;5(7):802-10. doi:10.1001/jamacardio.2020.0950.
14. Tavazzi G, Pellegrini C, Maurelli M, et al. Myocardial localization of coronavirus in COVID-19 cardiogenic shock. Eur J Heart Fail. 2020;22(5):911-5. doi:10.1002/ejhf.1828.
15. Wenzel P, Kopp S, Göbel S, et al. Evidence of SARS-CoV-2 mRNA in endomyocardial biopsies of patients with clinically suspected myocarditis tested negative for COVID19 in nasopharyngeal swab. Cardiovasc Res. 2020;116(10):1661-3. doi:10.1093/cvr/cvaa160.
16. Kim IC, Kim JY, Kim HA, et al. COVID-19-related myocarditis in a 21-year-old female patient. Eur Heart J. 2020;41(19):1859. doi:10.1093/eurheartj/ehaa288.
17. Lindner D, Fitzek A, Bräuninger H, et al. Association of Cardiac Infection With SARS-CoV-2 in Confirmed COVID-19 Autopsy Cases. JAMA Cardiol. 2020;5(11):1281-5. doi:10.1001/jamacardio.2020.3551.
18. Giustino G, Pinney SP, Lala A, et al. Coronavirus and Cardiovascular Disease, Myocardial Injury, and Arrhythmia: JACC Focus Seminar. J Am Coll Cardiol. 2020;76(17):2011-23. doi:10.1016/j.jacc.2020.08.059.
19. Andréoletti L, Bourlet T, Moukassa D, et al. Enteroviruses can persist with or without active viral replication in cardiac tissue of patients with end-stage ischemic or dilated cardiomyopathy. J Infect Dis. 2000;182(4):1222-7. doi:10.1086/315818.
20. Marjomäki V, Kalander K, Hellman M, et al. Enteroviruses and coronaviruses: similarities and therapeutic targets. Expert Opin Ther Targets. 2021;25(6):479-89. doi:10.1080/14728222.2021.1952985.
21. Scott AJ, O’Dea KP, O’Callaghan D, et al. Reactive oxygen species and p38 mitogenactivated protein kinase mediate tumor necrosis factor α-converting enzyme (TACE/ ADAM-17) activation in primary human monocytes. J Biol Chem. 2011;286(41):35466-76. doi:10.1074/jbc.M111.277434.
22. Basso C, Leone O, Rizzo S, et al. Pathological features of COVID-19-associated myocardial injury: a multicentre cardiovascular pathology study. Eur Heart J. 2020;41(39):3827-35. doi:10.1093/eurheartj/ehaa664.
23. Fox SE, Li G, Akmatbekov A, et al. Unexpected Features of Cardiac Pathology in COVID-19 Infection. Circulation. 2020;142(11):1123-5. doi:10.1161/CIRCULATIONAHA.120.049465.
24. Tao Z, Chen B, Tan X, et al. Coexpression of VEGF and angiopoietin-1 promotes angiogenesis and cardiomyocyte proliferation reduces apoptosis in porcine myocardial infarction (MI) heart. Proc Natl Acad Sci USA. 2011;108(5):2064-9. doi:10.1073/pnas.1018925108.
25. Dallabrida SM, Ismail N, Oberle JR, et al. Angiopoietin-1 promotes cardiac and skeletal myocyte survival through integrins. Circ Res. 2005;96(4):e8-24. doi:10.1161/01.RES.0000158285.57191.60.
26. Ray PS, Estrada-Hernandez T, Sasaki H, et al. Early effects of hypoxia/reoxygenation on VEGF, ang-1, ang-2 and their receptors in the rat myocardium: implications for myocardial angiogenesis. Mol Cell Biochem. 2000;213(1-2):145-53. doi:10.1023/a:1007180518474.
27. Mojiri A, Alavi P, Lorenzana Carrillo MA, et al. Endothelial cells of different organs exhibit heterogeneity in von Willebrand factor expression in response to hypoxia. Atherosclerosis. 2019;282:1-10. doi:10.1016/j.atherosclerosis.2019.01.002.
28. Spiel AO, Gilbert JC, Jilma B. von Willebrand factor in cardiovascular disease: focus on acute coronary syndromes. Circulation. 2008;117(11):1449-59. doi:10.1161/CIRCULATIONAHA.107.722827.
29. Witsch T, Martinod K, Sorvillo N, et al. Recombinant Human ADAMTS13 Treatment Improves Myocardial Remodeling and Functionality After Pressure Overload Injury in Mice. J Am Heart Assoc. 2018;7(3):e007004. doi:10.1161/JAHA.117.007004.
30. Smeeth L, Thomas SL, Hall AJ, et al. Risk of myocardial infarction and stroke after acute infection or vaccination. N Engl J Med. 2004;351(25):2611-8. doi:10.1056/NEJMoa041747.
31. Hirsch JS, Ng JH, Ross DW, et al. Acute kidney injury in patients hospitalized with COVID19. Kidney Int. 2020;98(1):209-18. doi:10.1016/j.kint.2020.05.006.
32. Bonow RO, Fonarow GC, O’Gara PT, et al. Association of Coronavirus Disease 2019 (COVID-19) With Myocardial Injury and Mortality. JAMA Cardiol. 2020;5(7):751-3. doi:10.1001/jamacardio.2020.1105.
33. Blanco-Melo D, Nilsson-Payant BE, Liu WC, et al. Imbalanced Host Response to SARSCoV-2 Drives Development of COVID-19. Cell. 2020;181(5):1036-45.e9. doi:10.1016/j.cell.2020.04.026.
Об авторах
Л. Б. МитрофановаРоссия
Главный научный сотрудник НИЛ патоморфологии, доктор медицинских наук, профессор кафедры патологической анатомии ИМО.
Санкт-Петербург
Конфликт интересов:
нет
И. А. Макаров
Россия
Врач-патологоанатом, клинический ординатор кафедры патологической анатомии ИМО.
Санкт-Петербург
Конфликт интересов:
нет
А. Л. Рунов
Россия
Инженер 1 категории НИО государственных эталонов и стандартных образцов в области биоаналитических и медицинских измерений.
Санкт-Петербург
Конфликт интересов:
нет
М. С. Вонский
Россия
И.о. руководителя НИО государственных эталонов и стандартных образцов в области биоаналитических и медицинских измерений.
Санкт-Петербург
Конфликт интересов:
нет
И. А. Данилова
Россия
Доктор медицинских наук, профессор кафедры патологической анатомии ИМО.
Санкт-Петербург
Конфликт интересов:
нет
В. С. Сидорин
Россия
Доктор медицинских наук, ведущий научный сотрудник НИЛ патоморфологии нервной системы.
Санкт-Петербург
Конфликт интересов:
нет
О. М. Моисеева
Россия
Доктор медицинских наук, директор Института сердца и сосудов, руководитель, главный научный сотрудник отдела некоронарогенных заболеваний сердца.
Санкт-Петербург
Конфликт интересов:
нет
А. О. Конради
Россия
Член-корр. РАН, профессор, доктор медицинских наук, зам. генерального директора по научной работе, зав. НИО артериальной гипертензии, зав. кафед рой организации управления и экономики здравоохранения Института медицинского образования Центра Алмазова.
Санкт-Петербург
Конфликт интересов:
нет
Дополнительные файлы
Рецензия
Для цитирования:
Митрофанова Л.Б., Макаров И.А., Рунов А.Л., Вонский М.С., Данилова И.А., Сидорин В.С., Моисеева О.М., Конради А.О. Клинико-морфологическое и молекулярно-биологическое исследование миокарда у пациентов с COVID-19. Российский кардиологический журнал. 2022;27(7):4810. https://doi.org/10.15829/1560-4071-2022-4810
For citation:
Mitrofanova L.B., Makarov I.A., Runov A.L., Vonsky M.S., Danilova I.A., Sidorin V.S., Moiseva O.M., Conradi A.O. Clinical, morphological and molecular biological examination of the myocardium in COVID-19 patients. Russian Journal of Cardiology. 2022;27(7):4810. (In Russ.) https://doi.org/10.15829/1560-4071-2022-4810
JATS XML

















































