Перейти к:
Факторы риска развития инфаркта миокарда при выполнении операции каротидной эндартерэктомии у пациентов с ишемической болезнью сердца высокого риска
https://doi.org/10.15829/1560-4071-2022-5267
Аннотация
Цель. Определить значимость различных факторов риска для прогнозирования развития инфаркта миокарда (ИМ) при выполнении операции каротидной эндартерэктомии (КЭАЭ) у пациентов с ишемической болезнью сердца (ИБС) высокого риска.
Материал и методы. В одноцентровое когортное проспективное исследование включено 204 больных с ИБС высокого риска, у которых была установлена необходимость выполнения операции КЭАЭ. Перед операцией всем больным проводилась медикаментозная коррекция ИБС, и все больные были клинически стабилизированы. Первым этапом выполнялась КЭАЭ. Были изучены клинические и диагностические факторы, связанные с риском развития периоперационного ИМ. Конечными точками исследования были: инсульт, ИМ, летальный исход от ИМ. Диагноз ИМ устанавливали при наличии сочетания повышения уровня тропонина cTn-I выше 99-го процентиля верхнего референсного предела с электрокардиографическими признаками ишемии миокарда, либо с болью в грудной клетке или эквивалентными симптомами и признаками, соответствующими ишемии миокарда.
Результаты. Инсультов не было. Летальности, связанной с ИМ, не было. Периоперационный ИМ развился у 8 (3,9%) пациентов. Установлено, что наиболее значимыми показателями для прогнозирования периоперационного ИМ оказались: наличие выраженных нарушений локальной сократимости левого желудочка (ЛЖ) (отношение рисков (ОР) 13,570; 95% доверительный интервал (ДИ) 1,427-124,782, р<0,05) и снижение фракции выброса ЛЖ <50% (ОР 10,909; 95% ДИ 1,052-271,229, р<0,05). Тогда как такие факторы, как: баллы по шкале SYNTAX, перенесённое острое нарушение мозгового кровообращения, перенесенный ИМ, наличие инсулинозависимого сахарного диабета, ожирения, хронической обструктивной болезни легких, оказались статистически незначимы для прогнозирования периоперационного ИМ (р>0,05).
Заключение. У пациентов с ИБС высокого риска наличие выраженных нарушений локальной сократимости и снижение глобальной систолической функции ЛЖ являются наиболее значимыми факторами риска развития периоперационного ИМ при проведении КЭАЭ.
Ключевые слова
Для цитирования:
Вачев А.Н., Терешина О.В., Дмитриев О.В., Белкин Ю.С., Лебедев П.А. Факторы риска развития инфаркта миокарда при выполнении операции каротидной эндартерэктомии у пациентов с ишемической болезнью сердца высокого риска. Российский кардиологический журнал. 2022;27(12):5267. https://doi.org/10.15829/1560-4071-2022-5267
For citation:
Vachev A.N., Tereshina O.V., Dmitriev O.V., Belkin Yu.S., Lebedev P.A. Risk factors for myocardial infarction during carotid endarterectomy in high-risk patients with coronary artery disease. Russian Journal of Cardiology. 2022;27(12):5267. (In Russ.) https://doi.org/10.15829/1560-4071-2022-5267
Наиболее распространенными перипроцедурными осложнениями операции каротидной эндартерэктомии (КЭАЭ) являются неврологические и кардиологические события [1]. Выполнение этим больным сочетанных операций на двух сосудистых бассейнах сопровождается более высоким числом перипроцедурных неврологических и кардиальных осложнений, чем при проведении операции в 2 этапа [2].
Актуальные рекомендации свидетельствуют о том, что целесообразнее выполнять КЭАЭ первым этапом, однако этапность и симультанность операций должна определяться на основе опыта учреждения и стратификации риска осложнений [3]. Поэтому определение стратегии профилактики кардиальных осложнений в группе пациентов с ишемической болезнью сердца (ИБС) высокого риска при проведении операции КЭАЭ является важной медицинской проблемой. В опубликованных работах по данному вопросу представлены результаты, полученные в отдельных центрах, но при этом сегодня не существует общепринятой модели для прогнозирования периоперационных кардиальных осложнений [4].
Цель работы: определить значимость различных факторов риска (ФР) для прогнозирования развития инфаркта миокарда (ИМ) при выполнении операции КЭАЭ у пациентов с ИБС высокого риска.
Материал и методы
В одноцентровое когортное проспективное исследование было включено 204 пациента с ИБС высокого риска, у которых имелись показания к выполнению КЭАЭ. Больные находились на лечении в Клинике с 2020 по август 2022гг.
Критерии включения:
1. Пациенты, которым показано выполнение КЭАЭ.
2. ИБС высокого риска (типичная стенокардия при низком уровне физической нагрузки (3 функциональный класс (ФК)), положительный результат стресс-эхокардиографии (ЭхоКГ), дисфункция левого желудочка (ЛЖ)).
3. Проведённая до операции медикаментозная коррекция ИБС привела к стабилизации больных до 2 ФК стенокардии.
4. Подтвержденная методом коронарной ангиографии ИБС.
Критерии исключения:
1. Выполнение повторной операции КЭАЭ.
2. Необходимость выполнения КЭАЭ в сочетании с другими сосудистыми вмешательствами на брахиоцефальных артериях.
3. Выполнение КЭАЭ в сочетании с коронарным шунтированием.
4. Стеноз ствола левой коронарной артерии >50%.
5. Отсутствие клинической стабилизации стенокардии при дооперационной медикаментозной коррекции.
Средний возраст пациентов составил 63,99±7,19 лет, мужчин было 90,2%. ИМ перенесли 58,8% пациентов. В исследование вошло 37,3% пациентов с симптомным поражением внутренней сонной артерии — неврологический эпизод в течение 6 мес. до операции. Демографические и анамнестические данные представлены в таблице 1. Клиническая характеристика больных приведена в таблице 2.
Показаниями к КЭАЭ были: 1. Симптомный стеноз внутренней сонной артерии 50-99%. 2. Асимптомный стеноз внутренней сонной артерии 60-99% с клиническими или визуализационными признаками нестабильной бляшки [5]. Степень стеноза оценивалась по NASCET. Морфологическая и гемодинамическая характеристика поражения сонных артерий представлена в таблице 3.
В связи с наличием ИБС высокого риска всем пациентам была выполнена коронарография. Пока - заниями к выполнению коронарной ангиографии были: стенокардия 3 ФК — 57 (27,9%) больных, дисфункция ЛЖ, указывающая на ИБС — 104 (51,0%) пациента, положительный стресс тест с аденозином — 43 (21,1%) пациента. Шкала SYNTAX (баллы) [6].
Всем пациентам выполнялось исследование уровня тропонина cTn-I, в день поступления и на первый день после операции.
Основные показатели данных дополнительных методов обследования представлены в таблице 4.
Всем пациентам выполняли ЭхоКГ на ультразвуковом сканере Philips CVX. Фракция выброса (ФВ) ЛЖ рассчитывалась при трехмерной ЭхоКГ с использованием программного обеспечения Multi Beat Dynamic Heart Model (Qlab, Philips) при усреднённом анализе 4 сердечных циклов (рис. 1). Среднее значение ФВ ЛЖ составило 53,98±7,42%, индекс нарушения локальной сократимости ЛЖ 1,18. Выраженным нарушением локальной сократимости считали величину индекса >1,7.
Всем больным при подготовке к операции под наблюдением кардиолога проводился подбор дозы β-адреноблокаторов до целевой частоты сердечных сокращений не >60 уд./мин. Кроме этого, медикаментозная коррекция ИБС также включала нитраты, ацетилсалициловую кислоту, блокаторы кальциевых каналов, ингибиторы ангиотензинпревращающего фермента и статины по показаниям. Первостепенным для выбора тактики этих больных был вопрос о том, как менялось клиническое состояние пациента после медикаментозной коррекции ИБС.
Учитывая то, что у всех этих пациентов при скорректированной в стационаре медикаментозной терапии ИБС в течение 5-7 дней стенокардия не превышала 2 ФК, мультидисциплинарным консилиумом в составе кардиолога, сердечно-сосудистого хирурга, невролога и анестезиолога принималось решение о возможности раздельного выполнения операции КЭАЭ и реваскуляризации миокарда (табл. 5).
Таблица 1
Демографические и анамнестические данные
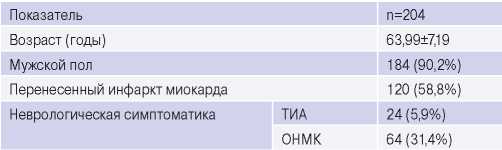
Сокращения: ОНМК — острое нарушение мозгового кровообращения, ТИА — транзиторная ишемическая атака.
Таблица 2
Клиническая характеристика больных при поступлении в клинику
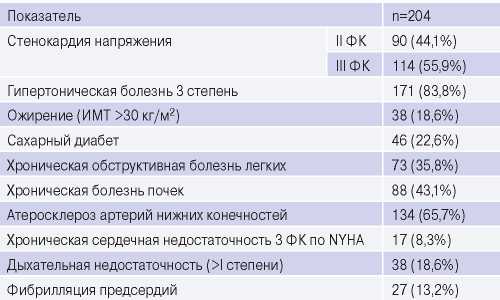
Сокращения: ИМТ — индекс массы тела, ФК — функциональный класс.
Таблица 3
Характеристика поражения сонных артерий
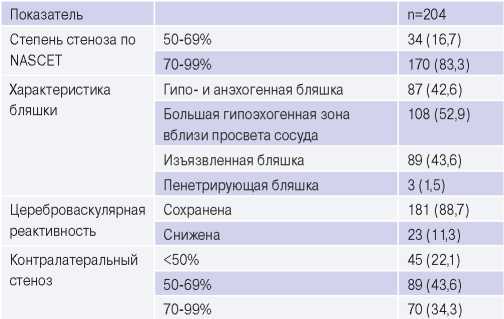
Таблица 4
Основные показатели данных дополнительных методов обследования
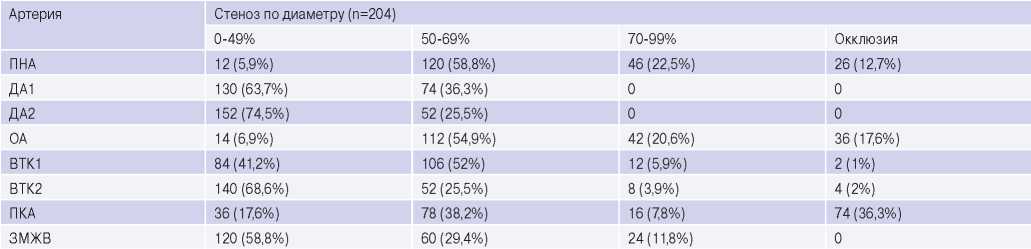
Сокращения: ВТК1 — первая ветвь тупого края, ВТК2 — вторая ветвь тупого края, ДА1 — первая диагональная артерия, ДА2 — вторая диагональная артерия, ЗМЖВ — задняя межжелудочковая ветвь, ОА — огибающая артерия, ПКА — правая коронарная артерия, ПНА — передняя нисходящая артерия.
Таблица 5
ФК стенокардии до и после медикаментозной коррекции в стационаре
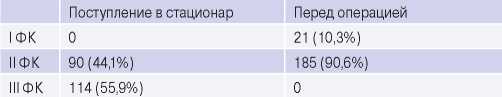
Сокращение: ФК — функциональный класс.
Зона реконструкции после операции КЭАЭ оценивались двукратно методом дуплексного сканирования: сразу после операции и перед выпиской из стационара.
Исходы. Конечными точками были инсульт, ИМ, летальный исход от ИМ.
ИМ определялся как сочетание повышения уровня тропонина cTn-I >99-го процентиля верхнего референтного предела, с электрокардиографическими признаками ишемии миокарда (вновь появившаяся депрессия или подъем сегмента ST на 1 мм в двух или более смежных отведениях, новая блокада левой ножки пучка Гиса или снижение вольтажа зубца R), либо с болью в грудной клетке или эквивалентными симптомами и признаками, соответствующими ишемии миокарда [7].
Статистический анализ. Нормальность распределения определяли с помощью критериев Колмогорова-Смирнова. Ординарные параметры представлены в виде перевода n в проценты (%), количественные признаки представлены в виде среднего значения и стандартного отклонения (M±SD), для данных с распределением, отличным от нормального, — в виде медианы (Mе) и интерквартильного интервала [Q25; Q75]. Качество взаимосвязи исследуемых переменных с исходом определяли методом множественной логистической регрессии с пошаговым включением предикторов. Оценивался риск развития неблагоприятного исхода под влиянием выявленных ФР (отношение рисков (ОР)) с 95% доверительным интервалом (ДИ). Все статистические тесты были двусторонними, значение p<0,05 считалось показателем статистической значимости. Статистический анализ производился с использованием программы IBM SPSS Statistics версии 26 (IBM Corporation, США).
Исследование было выполнено в соответствии со стандартами надлежащей клинической практики (Good Clinical Practice) и принципами Хельсинкской декларации. Протокол исследования был одобрен этическим комитетом. До включения в исследование у всех участников было получено письменное информированное согласие.
Результаты
Летальных исходов и инсультов не было. В исследуемой группе (n=204) произошло 8 (3,9%) значимых неблагоприятных кардиальных осложнений в виде развития госпитального не летального ИМ. Болевой синдром не был зарегистрирован ни у одного больного. Все пациенты, у которых развился ИМ, были гемодинамически стабильны. У всех 8 пациентов диагноз ИМ был поставлен на основании повышения уровня тропонина сТн >99-го процентиля верхнего референтного предела и изменений сегмента ST. У 6 пациентов была зарегистрирована новая горизонтальная или косонисходящая депрессия сегмента на ST ≥0,5 мм, как минимум в двух последовательных отведениях, у 2 пациентов была зарегистрирована инверсия зубца Т >1 мм в двух последовательных отведениях с выраженным зубцом R. Подъема сегмента ST и формирования патологического зубца Q не было выявлено ни у одного пациента. Всем 8 пациентам с развившемся ИМ была выполнена повторная коронарная ангиография. Дополнительных изменений по сравнению с исходной коронароангиографией выявлено не было. В связи со значимым поражением передней нисходящей артерии 3 пациентам было выполнено стентирование. Остальным 5 пациентам рекомендовано выполнение аортокоронарного шунтирования в плановом порядке.
Подгруппы пациентов с развитием периоперационного ИМ и без него значимо не различались по большинству клинических показателей. Единственным параметром, который достоверно чаще выявлялся среди пациентов с периоперационным ИМ, было дооперационно установленное снижение ФВ ЛЖ (табл. 6).
Далее, выполнив многомерный логистический регрессионный анализ, мы проанализировали взаимосвязь между отдельными клиническими факторами и риском развития ИМ. Первым этапом строили модель множественной логистической регрессии с пошаговым включением предикторов, затем производилась оценка влияния выявленных факторов на исход. Данные представлены в таблице 7.
Оказалось, что такие показатели, как снижение ФВ ЛЖ <50% (ОР 10,9; ДИ 95% 1,052-271,229, p<0,05) и выраженное нарушение локальной сократимости (ОР 13,57; ДИ 95% 1,427-124,782, p<0,05) сопряжены с повышенным риском развития периоперационного ИМ у пациентов при выполнении КЭАЭ.
Таблица 6
Сравнительная характеристика подгрупп пациентов с развитием периоперационного ИМ и без развития кардиальных осложнений
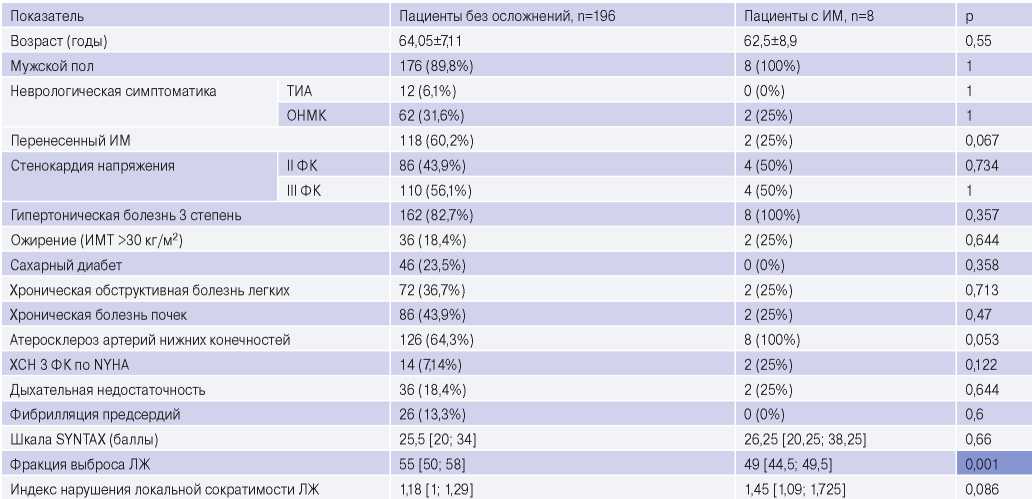
Сокращения: ИМ — инфаркт миокарда, ИМТ — индекс массы тела, ЛЖ — левый желудочек, ОНМК — острое нарушение мозгового кровообращения, ТИА — транзиторная ишемическая атака, ФК — функциональный класс, ХСН — хроническая сердечная недостаточность.
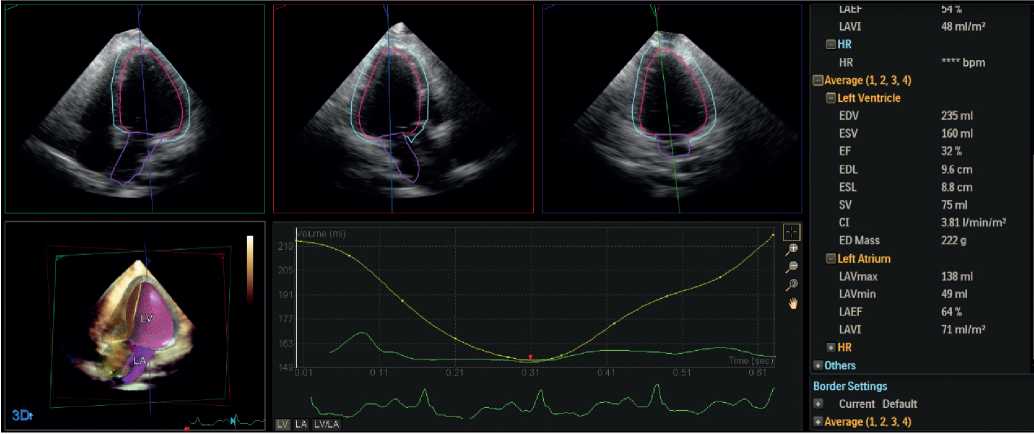
Рис. 1. ЭхоКГ перед выполнением операции КЭАЭ с расчетом 3D объема и 3D ФВ ЛЖ, усредненных за 4 сердечных цикла. Увеличение объема ЛЖ (конечный диастолический объем 235 мл) и снижение систолической функции ЛЖ (32%).
Таблица 7
Оценка влияния клинических ФР на развитие периоперационного ИМ

Сокращения: ДИ — доверительный интервал, ИМ — инфаркт миокарда, ИНЛС — индекс нарушения локальной сократимости, ТИА — транзиторная ишемическая атака, ЛЖ — левый желудочек, ОНМК — острое нарушение мозгового кровообращения, ОР — отношение рисков, ХОБЛ — хроническая обструктивная болезнь легких.
Обсуждение
Большинство пациентов, которым необходимо выполнить сосудистое вмешательство, имеют поражение коронарных артерий [8]. У пациентов, которым проводится КЭАЭ, значимые поражения коронарных артерий выявляются в 20-30% [9]. КЭАЭ у симптомных и асимптомных пациентов относится к группе операций промежуточного кардиального риска (1-5%) [10].
Сегодня не существует однозначных клинических рекомендаций по расширенному предоперационному обследованию пациентов этой группы. Указывается, что выполнение ЭхоКГ перед внекардиальным вмешательством промежуточного риска может быть рассмотрено у пациентов с низким функциональным статусом, патологической электрокардиограммой, высоким уровнем N-концевого промозгового и мозгового натрийуретических пептидов (NT-proBNP/BNP) или ≥1 клиническим ФР (класс IIb, уровень доказательности B) [10]. Стресс-визуализация может быть рассмотрена при подозрении на ишемию у пациентов с клиническими ФР и низкими функциональными возможностями (класс IIb, уровень доказательности B) [10]. Предоперационная коронарная ангиография может быть рассмотрена у стабильных пациентов с хроническим коронарным синдромом, подвергающихся плановой хирургической КЭАЭ (класс IIb, уровень доказательности B) [10]. Стоит отметить, что все рекомендации о дополнительном обследовании имеют низкий класс и уровень доказательности.
Данный факт в реальной клинической практике позволяет врачам достаточно свободно трактовать необходимость выполнения дополнительных исследований. Таким образом, объем обследования и стратификации кардиального риска перед КЭАЭ зависят от предпочтений и опыта каждого конкретного центра.
В проведенном исследовании степень поражения коронарного русла по шкале SYNTAX оказалась статистически не значима с развитием периоперационных ИМ. Это указывает на то, что анатомическая степень сужения коронарного русла не всегда может служить единственным достоверным индикатором риска кардиальных событий. Необходимо учитывать функциональную значимость стеноза по фракционному резерву кровотока, стресс-тестированию, ответу на медикаментозную терапию и наличию глобальной и локальной дисфункции миокарда ЛЖ [6].
Существующие различные шкалы риска включают такие переменные, как неврологическая симптоматика, наличие поражения периферических артерий, возраст, сахарный диабет [11].
В выполненном исследовании 6 из 8 больных, у которых развился ИМ, были асимптомны по неврологическому статусу. Полученные результаты подтверждают данные авторов, которые сообщили о том, что наличие перенесенного нарушения мозгового кровообращения не связано со значимым увеличением частоты периоперационных кардиальных осложнений [12].
В отдельных работах указано, что поражение периферических артерий независимо предсказывало неблагоприятные кардиальные события [13]. Однако мы не выявляли этого в анализируемой группе больных. Наличие инсулинозависимого сахарного диабета также не было связано с увеличением кардиального риска в выполненном исследовании. Это согласуется с данными одних исследователей [14] и противоречит результатам других авторов [15]. В целом это отражает противоречивое отношение к сахарному диабету как ФР кардиальных осложнений при КЭАЭ.
Возраст традиционно считается независимым предиктором периоперационных сердечно-сосудистых событий, ФР выполнения открытой операции КЭАЭ и возможного предпочтения эндоваскулярной реваскуляризации [16]. Однако в выполненном исследовании увеличение частоты кардиальных осложнений после КЭАЭ у больных с ИБС не коррелировало с возрастом. Это подтверждает мнение исследователей, которые показали отсутствие увеличения кардиальных осложнений при выполнении КЭАЭ и летальности у пожилых пациентов [16].
Единственными факторами, значимо связанными с развитием периоперационного ИМ, в выполненном исследовании были эхокардиографические показатели локальной и глобальной дисфункции ЛЖ. Исходя из того факта, что наличие дисфункции ЛЖ может быть основанием для проведения коронарной ангиографии согласно актуальным рекомендациям [6], следует признать обоснованным обязательное рутинное выполнение ЭхоКГ у всех пациентов перед операцией КЭАЭ, вне зависимости от функционального статуса, наличия изменений на электрокардиограмме, уровня N-концевого промозгового и мозгового натрийуретических пептидов (NT-proBNP/BNP) или наличия клинических ФР.
Заключение
Пациентам перед операцией КЭАЭ следует рекомендовать проведение ЭхоКГ для выявления дисфункции ЛЖ. Значимыми ЭхоКГ ФР развития периоперационного ИМ при выполнении операции КЭАЭ следует считать наличие глобальной систолической дисфункции ЛЖ и выраженные нарушения локальной сократимости ЛЖ.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Список литературы
1. Акчурин Р. С., Ширяев А. А., Галяутдинов Д. М. и др. Непосредственные результаты одномоментной операции коронарного шунтирования и каротидной эндартерэктомии. Кардиология и сердечно-сосудистая хирургия. 2017;10(6):4-8. doi:10.17116/kardio20171064-8.
2. Chan JSK, Shafi AMA, Grafton-Clarke C, et al. Concomitant severe carotid and coronary artery diseases: a separate management or concomitant approach. J Card Surg. 2019;34(9):803-13. doi:10.1111/jocs.14145.
3. Abu Rahma AF, Avgerinos ED, Chang RW, et al. Society for Vascular Surgery clinical practice guidelines for management of extracranial cerebrovascular disease. Journal of vascular surgery. 2022;75(1S):4S-22S. doi:10.1016/j.jvs.2021.04.073.
4. Шейкина Н. А., Керен М. А. Проблема выбора оптимальной хирургической тактики лечения больных с критическим поражением коронарных и каротидных артерий. Грудная и сердечно-сосудистая хирургия. 2022;3(64):252-9. doi:10.24022/0236-27912022-64-3-252-258.
5. Aboyans V, Ricco JB, Bartelink M, et al. ESC Guidelines on the Diagnosis and Treatment of Peripheral Arterial Diseases, in collaboration with the European Society for Vascular Surgery (ESVS): Document covering atherosclerotic disease of extracranial carotid and vertebral, mesenteric, renal, upper and lower extremity arteriesEndorsed by: the European Stroke Organization (ESO)The Task Force for the Diagnosis and Treatment of Peripheral Arterial Diseases of the European Society of Cardiology (ESC) and of the European Society for Vascular Surgery (ESVS). European heart journal. 2017;39(9):763-816. doi:10.1093/eurheartj/ehx095.
6. 2019 Рекомендации ЕSC по диагностике и лечению хронического коронарного синдрома. Российский кардиологический журнал. 2020;25(2):3757. doi:10.15829/1560-4071-2020-2-3757.
7. Fourth universal definition of myocardial infarction (2018). Russian Journal of Cardiology. 2019;(3):107-38. (In Russ.) Четвертое универсальное определение инфаркта миокарда (2018) (текст доступен в электронной версии). Российский кардиологический журнал. 2019;(3):107-38. doi:10.15829/1560-4071-2019-3-107-138.
8. Tomai F, Piccoli A, Castriota F, et al. Long-Term Outcomes of Coronary and Carotid Artery Disease Revascularization in the FRIENDS Study. Journal of interventional cardiology. 2019;8586927. doi:10.1155/2019/8586927.
9. Drakopoulou M, Oikonomou G, Soulaidopoulos S, et al. Management of patients with concomitant coronary and carotid artery disease. Expert review of cardiovascular therapy. 2019;17(8):575-83. doi:10.1080/14779072.2019.1642106.
10. Halvorsen S, Mehilli J, Cassese S, et al. 2022 ESC Guidelines on cardiovascular assessment and management of patients undergoing non-cardiac surgery. European heart journal. 2022;43(39):3826-924. doi:10.1093/eurheartj/ehac270.
11. Moses DA, Johnston LE, Tracci MC, et al. Estimating risk of adverse cardiac event after vascular surgery using currently available online calculators. J Vasc Surg. 2018;01;67(1):272-8. doi:10.1016/j.jvs.2017.06.105.
12. Che L, Xu L, Huang Y, et al. Clinical utility of the revised cardiac risk index in older Chinese patients with known coronary artery disease. Clinical interventions in aging. 2017;13:3541. doi:10.2147/CIA.S144832.
13. Smilowitz NR, Gupta N, Ramakrishna H, et al. Perioperative Major Adverse Cardiovascular and Cerebrovascular Events Associated With Noncardiac Surgery. JAMA cardiology. 2017;2(2):181-7. doi:10.1001/jamacardio.2016.4792.
14. Damaskos C, Garmpis N, Kollia P, et al. Assessing Cardiovascular Risk in Patients with Diabetes: An Update. Current cardiology reviews. 2020;16(4):266-74. doi:10.2174/1573403X15666191111123622.
15. Hansen PW, Gislason GH, Jørgensen ME, et al. Influence of age on perioperative major adverse cardiovascular events and mortality risks in elective non-cardiac surgery. European journal of internal medicine. 2016;35:55-9. doi:10.1016/j.ejim.2016.05.028.
16. Droz NM, Lyden SP, Smolock CJ, et al. Carotid endarterectomy remains safe in high-risk patients. J Vasc Surg. 2020:S0741-5214(20)32144-3. doi:10.1016/j.jvs.2020.08.149.
Об авторах
А. Н. ВачевРоссия
Алексей Николаевич Вачев — доктор медицинских наук, профессор, заведующий кафедрой факультетской хирургии.
Самара
Конфликт интересов:
все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье
О. В. Терешина
Россия
Ольга Владимировна Терешина — доцент кафедры терапии Института профессионального образования, заведующий отделением функциональной диагностики Клиник,SPIN-код: 3714-7675, AuthorID: 450045.
Самара
Конфликт интересов:
все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье
О. В. Дмитриев
Россия
Олег Владимирович Дмитриев — доцент кафедры факультетской хирургии, заведующий отделением сердечно-сосудистой хирургии Клиник.
Самара
Конфликт интересов:
все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье
Ю. С. Белкин
Россия
Юрий Сергеевич Белкин — клинический ординатор кафедры факультетской хирургии.
Самара
Конфликт интересов:
все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье
П. А. Лебедев
Россия
Петр Алексеевич Лебедев — доктор медицинских наук, профессор, заведующий кафедрой терапии ИПО.
Самара
Конфликт интересов:
все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье
Дополнительные файлы
Рецензия
Для цитирования:
Вачев А.Н., Терешина О.В., Дмитриев О.В., Белкин Ю.С., Лебедев П.А. Факторы риска развития инфаркта миокарда при выполнении операции каротидной эндартерэктомии у пациентов с ишемической болезнью сердца высокого риска. Российский кардиологический журнал. 2022;27(12):5267. https://doi.org/10.15829/1560-4071-2022-5267
For citation:
Vachev A.N., Tereshina O.V., Dmitriev O.V., Belkin Yu.S., Lebedev P.A. Risk factors for myocardial infarction during carotid endarterectomy in high-risk patients with coronary artery disease. Russian Journal of Cardiology. 2022;27(12):5267. (In Russ.) https://doi.org/10.15829/1560-4071-2022-5267

















































